
【題目】NA表示阿伏加德羅常數,下列說法中正確的是( )
A. 足量Fe與1molCl2完全反應,轉移電子的數目為3NA
B. 22.4 L 氧氣含有的分子數為NA
C. 常溫常壓下,28 g氮氣所含的原子數為2NA
D. 0.1 mol/L的氯化鋁溶液中,含有Cl的數目為0.3NA
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】亞硝酸鈣是一種阻銹劑,可用于染料工業,某興趣小組擬制備Ca(NO2)2并對其性質進行探究。
(背景素材)
Ⅰ.NO+NO2+Ca(OH)2=Ca(NO2)2+H2O。
Ⅱ.Ca(NO2)2能被酸性KMnO4溶液氧化成NO3—,MnO4—被還原為Mn2+。
Ⅲ.在酸性條件下,Ca(NO2)2能將I氧化為I2,S2O32—能將I2還原為I。
(制備氮氧化物)
(1)甲組同學擬利用如下左圖所示裝置制備氮氧化物。

①儀器X、Y的名稱分別是______________、______________。
②裝置B中逸出的NO與NO2的物質的量之比為1∶1,則裝置B中發生反應的化學方程式為______,若其他條件不變,增大硝酸的濃度,則會使逸出的氣體中n(NO2)__________n(NO)(填“>”或“<”)。
(制備Ca(NO2)2)
(2)乙組同學擬利用裝置B中產生的氮氧化物制備Ca(NO2)2,裝置如上右圖。
①裝置C中導管末端接一玻璃球的作用是________________。
②裝置D的作用是______________;裝置E的作用是________________。
(測定Ca(NO2)2的純度)
(3)丙組同學擬測定Ca(NO2)2的純度(雜質不參加反應),可供選擇的試劑:
a.稀硫酸 b.c1mol·L1的KI溶液 c.淀粉溶液 d.c2 mol·L1的Na2S2O3溶液 e.c3mol·L1的酸性KMnO4溶液
①利用Ca(NO2)2的還原性來測定其純度,可選擇的試劑是__________(填字母)。
②利用Ca(NO2)2的氧化性來測定其純度的步驟:準確稱取mgCa(NO2)2樣品放入錐形瓶中,加適量水溶解,_______(請補充完整實驗步驟)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將共0.4molMg、Al的混合物用鹽酸完全溶解,放出標準狀況下11.2L氣體,然后再滴2mol/LNaOH溶液,請回答:
(1)求該混合物中Mg、Al的物質的量之比______________
(2)若該Mg、Al的混合物與鹽酸恰好完全反應,在滴加NaOH溶液過程中,欲使Mg2+、Al3+剛好沉淀完全,則滴入NaOH溶液的體積V=________________ mL。
(3)若該Mg、Al混合物溶于400mL 3mol/L鹽酸后,滴入NaOH溶液,使所得沉淀中無Al(OH)3,則滴入NaOH溶液的體積最少為 _____________________ mL。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向50 mL 18 mol·L-1的H2SO4溶液中加入適量的銅片并加熱。充分反應后,被還原的H2SO4的物質的量( )
A. 小于0.45 mol B. 等于0.45 mol
C. 在0.45~0.90 mol之間 D. 大于0.45 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鑭系金屬元素鈰(Ce)常見有+3、+4兩種價態,鈰的合金耐高溫,可以用來制造噴氣推進器零件。請回答下列問題:
(1)霧霾中含有的污染物NO可以被含Ce4+的溶液吸收,生成![]() 物質的量之比為1∶1,試寫出該反應的離子方程式______________________________________________。
物質的量之比為1∶1,試寫出該反應的離子方程式______________________________________________。
(2)用電解的方法可將上述吸收液中的![]() 轉化為穩定的無毒氣體,同時再生Ce4+,其原理如圖所示。
轉化為穩定的無毒氣體,同時再生Ce4+,其原理如圖所示。
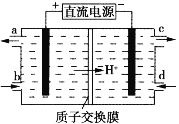
①無毒氣體從電解槽的___________(填字母序號)口逸出。
②每生成標準狀況下22.4 L無毒氣體,同時可再生Ce4+_____________mol。
(3)鈰元素在自然界中主要以氟碳鈰礦形式存在,其主要化學成分為CeFCO3。工業上利用氟碳鈰礦提取CeCl3的一種工藝流程如下:
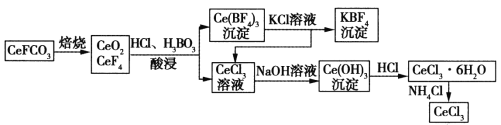
①焙燒過程中發生的主要反應的氧化劑和還原劑的物質的量之比為______________。
②假設參與酸浸反應的CeO2和CeF4的物質的量之比為3∶1,試寫出相應的化學方程式________________________________________。
③向Ce(BF4)3中加入KCl溶液的目的是________________________________________。
④常溫下,當溶液中的某離子濃度![]() 時,可認為該離子沉淀完全。據此,在生成Ce(OH)3的反應中,加入NaOH溶液至pH至少達到____________時,即可視為Ce3 +已完全沉淀。
時,可認為該離子沉淀完全。據此,在生成Ce(OH)3的反應中,加入NaOH溶液至pH至少達到____________時,即可視為Ce3 +已完全沉淀。![]()
⑤加熱CeCl3·6H2O和NH4Cl的固體混合物可得固體無水CeCl3,其中NH4Cl的作用是______________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅及其化合物在科學研究和工業生產中具有許多用途。請回答下列問題:
(1)畫出基態Cu原子的價電子排布圖__________________;
(2)已知高溫下Cu2O比CuO穩定,從核外電子排布角度解釋高溫下Cu2O更穩定的原因_________________________________________________________________________。
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的雜化類型是____________,配體中提供孤對電子的原子是____________。C、N、O三元素的第一電離能由大到小的順序是__________(用元素符號表示)。
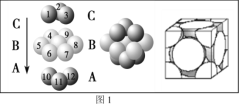
(4)銅晶體中銅原子的堆積方式如圖1所示,則晶體銅原子的堆積方式為________________。
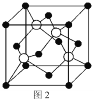
(5)M原子的價電子排布式為3s23p5,銅與M形成化合物的晶胞如圖2所示(白球代表銅原子)。
①該晶體的化學式為_________________。
②已知銅和M的電負性分別為1.9和3.0,則銅與M形成的化合物屬于_________化合物(填“離子”、“共價”)
③已知該晶體的密度為![]() g/cm3,阿伏加德羅常數的值為NA,則該晶體中Cu原子和M原子之間的最短距離為_________pm(寫出計算式)。
g/cm3,阿伏加德羅常數的值為NA,則該晶體中Cu原子和M原子之間的最短距離為_________pm(寫出計算式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬和非金屬被廣泛應用于人類生產生活中。
(1)胃液中含有鹽酸,胃酸過多的人常有胃疼燒心的感覺,易吐酸水,服用含有小蘇打的藥品以中和過多的胃酸,其反應的離子方程式:___________________________;
(2)中華透明牙膏摩擦劑SiO2是工業制備晶體硅的原料,工業上制粗硅的反應原理是 __________;(用化學反應方程式表示)。
(3)硅酸鈉的水溶液俗稱水玻璃,向其中通入過量的CO2,會出現膠狀沉淀,其離子方程式是_________;
(4)人體血紅蛋白中含有Fe2+,若誤食亞硝酸鹽,會導致Fe2+轉化Fe3+而中毒,服用維生素C可以解毒.對上述的分析正確的是(______)
A.亞硝酸鹽是還原劑 B.維生素C是氧化劑
C.維生素C被氧化 D.亞硝酸鹽發生氧化反應
(5)化學與生產、生活、社會等密切相關,下列說法正確的是(_______)
A. 二氧化硫具有漂白性,可用來增白紙漿、草帽辮、食品等
B. 酸雨是空氣中二氧化碳含量超標引起的
C.工業上合成氨氣可用濃氨水和生石灰混合制得
D.蔗糖中加入濃硫酸后出現發黑現象,說明濃硫酸具有吸水性
E.洪災過后,飲用水的消毒殺菌成為抑制大規模傳染性疾病爆發的有效方法之一,漂白粉是常用的消毒劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,回答下列有關問題:
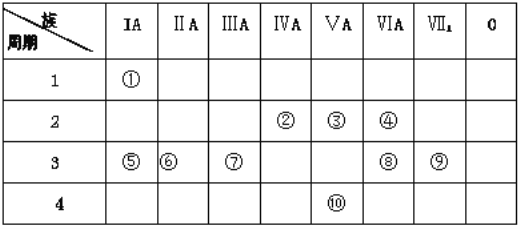
(1)從⑤到⑨元素中非金屬性較強的元素是_________(用元素符號表示),這些元素的最高價氧化物對應的水化物中堿性最強的是 _________ (填化學式)。
(2)寫出元素④具有強氧化性的氫化物的電子式:_______________。
(3)寫出一種由①、③、④三種元素形成的常見離子化合物:________________。
(4)用電子式表示⑥、⑨形成化合物的過程:_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于濃硫酸特性的敘述不正確的是
A. 濃硫酸具有吸水性、脫水性和強氧化性等特性
B. 濃硫酸能吸收氣體中的水蒸氣,常作氨氣、二氧化硫等氣體的干燥劑
C. 濃硫酸可以吸收固體中的濕存水、結晶水合物中的結晶水
D. 在反應C12H22O11![]() 12C+11H2O,濃硫酸作脫水劑
12C+11H2O,濃硫酸作脫水劑
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com