
某溫度下,向pH=6的蒸餾水中,加入NaHSO4晶體,保持溫度不變,測得溶液的pH為2 ,下列對該溶液的敘述中不正確的是
| A.該溫度下加入等體積pH=12的NaOH溶液可使該溶液恰好呈中性 |
| B.由水電離出來的H+的濃度是1.0×10-10mol/L |
| C.加入NaHSO4晶體抑制了水的電離 |
| D.該溫度高于25℃ |
A
解析試題分析:A、純水的pH=6,說明c(H+)=c(OH-)=1×10-6mol?L-1,Kw=1×10-12,應加入等體積濃度為0.01mol?L-1的氫氧化鈉溶液,故應加入等體積pH=10的NaOH溶液,可使該溶液恰好呈中性,故A不正確; B、水電離出來的氫離子的濃度等于溶液中氫氧根的濃度,c(H+)=c(OH-)= =10-12÷0.01=1×10-10mol?L-1,故B正確;C、NaHSO4晶體電離生成氫離子,相當于一元強酸,抑制了水的電離,故C正確;D、純水的pH=6,說明c(H+)=c(OH-)=1×10-6mol?L-1,Kw=1×10-12>1×10-14,說明溫度高于25℃,故D正確,故答案選A。
=10-12÷0.01=1×10-10mol?L-1,故B正確;C、NaHSO4晶體電離生成氫離子,相當于一元強酸,抑制了水的電離,故C正確;D、純水的pH=6,說明c(H+)=c(OH-)=1×10-6mol?L-1,Kw=1×10-12>1×10-14,說明溫度高于25℃,故D正確,故答案選A。
考點:考查水的電離;pH的簡單計算


 勵耘書業暑假銜接寧波出版社系列答案
勵耘書業暑假銜接寧波出版社系列答案科目:高中化學 來源: 題型:單選題
室溫下,用0.100 0 mol·L-1NaOH溶液分別滴定體積均為20.00 mL的鹽酸和醋酸溶液,滴定曲線如右圖。下列說法正確的是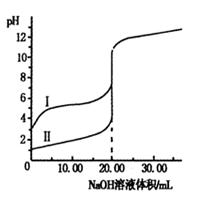
| A.I、Ⅱ分別表示鹽酸和醋酸的滴定曲線 |
| B.鹽酸和醋酸的濃度均為0.100 0 mol·L-1 |
| C.pH=7時,兩種酸所消耗NaOH溶液的體積相等 |
| D.V(NaOH)=20.00mL時,c(Cl一)=c(CH3COO一) |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列敘述不正確的是
| A.在稀鹽酸中c(H+)=c(Cl-)+c(OH-) |
| B.常溫下,在0.1mol/L的硫酸銨溶液中由水電離出的c(OH-)>10-7mol/L |
| C.如果Na2A的水溶液顯中性,該溶液中一定沒有電離平衡 |
| D.熱水中加入硫酸鈉溶解至飽和,此時溶液的pH小于7 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
0.1mol·L-1HF溶液的pH=2,則該溶液中有關濃度關系式不正確的是( )
| A.c(H+)>c(F-) | B.c(H+)>c(HF) |
| C.c(OH-)<c(HF) | D.c(HF)>c(F-) |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列離子方程式中,屬于水解反應的是( )
A.HCOOH+H2O HCOO-+H3O+ HCOO-+H3O+ |
B.CO2+H2O HCO3-+H+ HCO3-+H+ |
C.CO32-+H2O HCO3-+OH- HCO3-+OH- |
D.HS-+H2O S2-+H3O+ S2-+H3O+ |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
25 ℃時,在等體積的①pH=0的硫酸溶液、②0.05 mol/L的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,發生電離的水的物質的量之比是( )
| A.1∶10∶1010∶109 | B.1∶5∶5×109∶5×108 |
| C.1∶20∶1010∶109 | D.1∶10∶104∶109 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知下面三個數據:7.2×10-4、4.6×10-4、4.9×10-10分別是三種酸的電離平衡常數,若已知這些酸可發生如下反應:
①NaCN+HNO2=HCN+NaNO2,
②NaCN+HF=HCN+NaF,
③NaNO2+HF=HNO2+NaF。
由此可判斷下列敘述中,不正確的是( )
| A.HF的電離平衡常數為7.2×10-4 |
| B.HNO2的電離平衡常數為4.9×10-10 |
| C.根據①③兩個反應即可知三種酸的相對強弱 |
| D.HNO2的電離平衡常數比HCN大,比HF小 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
50℃時,下列各溶液中,離子的物質的量濃度關系正確的是( )
| A.pH=4的醋酸中:c(H+)=4.0 mol·L-1 |
| B.飽和小蘇打溶液中:c(Na+)=c(HCO3—) |
| C.飽和食鹽水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
| D.pH=12的純堿溶液中:c(OH-)=1.0×10-2 mol·L-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com