
【題目】以氧化鋁為原料,通過碳熱還原法可合成氮化鋁(AlN);通過電解法可制取鋁。電解鋁時陽極產生的CO2可通過二氧化碳甲烷化等再利用。請回答:
(1)已知:①.2Al2O3(s)=4Al(g)+3O2(g) △H1=+3351kJ/mol
②. 2C(s)+ O2(g)=2CO(g) △H2=-221kJ/mol
③. 2Al(g)+ N2(g)=2AlN(s) △H3=a kJ/mol
④. Al2O3(s)+ 3C(s)+ N2(g)=2AlN(s)+3CO(g) △H4=+1026kJ/mol
反應③的a=______,反應④自發進行的條件是______(填“高溫”、“低溫”或“任意溫度”)
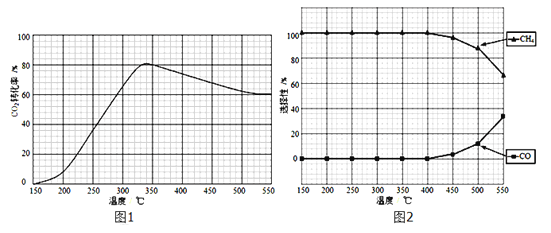
(2)在常壓、Ru/TiO2催化下,CO2和H2混和氣體(體積比1:4,總物質的量x mol)進行反應,測得CO2轉化率、CH4和CO選擇性隨溫度變化情況分別如圖1和圖2所示(選擇性:轉化的CO2中生成CH4或CO的百分比)。
反應ⅠCO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H4
CH4(g)+2H2O(g)△H4
反應ⅡCO2(g)+H2(g)![]() CO(g)+H2O(g)△H5
CO(g)+H2O(g)△H5
①下列說法正確的是___________。
A.△H5 小于零
B.溫度可影響產物的選擇性
C.CO2平衡轉化率隨溫度升高先增大后減少
D.其他條件不變,將CO2和H2的初始體積比改變為1:3,可提高CO2平衡轉化率
②350℃時,反應I在t1時刻達到平衡,平衡時容器體積為yL,該溫度下反應I的平衡常數為____(用x、y 表示)。
(3)CO2溶于水形成H2CO3。已知常溫下H2CO3 的電離平衡常數K1=4.4×10-7,K2=4.7×10-11,NH3·H2O的電離平衡常數Kb=1.75×10-5。常溫下,用氨水吸收CO2 可得到NH4HCO3 溶液,NH4HCO3 溶液顯______(填“ 酸 性”、“ 中性” 或“ 堿性”);請計算反應NH4++HCO3-+ H2O![]() NH3·H2O+H2CO3 的平衡常數K=_____________。
NH3·H2O+H2CO3 的平衡常數K=_____________。
(4)據文獻報道,二氧化碳可以在酸性水溶液中用情性電極電解得到乙烯,其原理如圖所示。
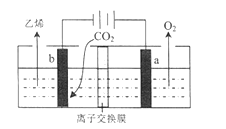
b電極上的電極反應式為____________________________,該裝置中使用的是________(“ 陰”或“ 陽”) 離子交換膜。
【答案】 -318 高溫 AB 625y2/x2 堿性 1.3×10-3 2CO2+12H++12e- ==== C2H4+4H2O 陽
【解析】(1). 已知①.2Al2O3(s)=4Al(g)+3O2(g) △H1=+3351kJ/mol,②. 2C(s)+ O2(g)=2CO(g) △H2=-221kJ/mol,③. 2Al(g)+ N2(g)=2AlN(s) △H3=a kJ/mol,④. Al2O3(s)+ 3C(s)+ N2(g)=2AlN(s)+3CO(g) △H4=+1026kJ/mol,根據蓋斯定律,(①+②×3+③×2)÷2=④,解得△H3=-318 kJ/mol;若△G=△H-T△S<0,則反應能自發進行,反應④的△H>0,△S>0,因此該反應能自發進行的條件為高溫,故答案為:-318;高溫;
(2).①. A. 根據圖1可知,CO2的轉化率先增大是因為反應正向進行,到一定溫度時達到平衡,升高溫度CO2的轉化率減小,說明正反應為放熱反應,△H5小于零,故A正確;B. 由圖2可知,隨溫度升高甲烷的選擇性降低,CO的選擇性增加,因此溫度可影響產物的選擇性,故B正確;C. CO2轉化率先增大是因為反應正向進行未達到平衡狀態,達到平衡狀態后,隨溫度升高CO2的轉化率減小,故C錯誤;D. CO2和H2混和氣體(體積比1:4,總物質的量x mol)進行反應,其他條件不變,將CO2和H2的初始體積比改變為1:3,相當于減小氫氣的量,CO2平衡轉化率減小,故D錯誤;答案為:AB;
②. 350℃時,反應I在t1時刻達到平衡,平衡時容器體積為yL,二氧化碳的轉化率為80%,根據三段式法有:
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
起始量(mol) 0.2x 0.8x 0 0
轉化量(mol) 0.16x 0.64x 0.16x 0.32x
平衡量(mol) 0.04x 0.16x 0.16x 0.32x
平衡常數K=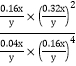 =625y2/x2,故答案為:625y2/x2;
=625y2/x2,故答案為:625y2/x2;
(3). 已知NH3·H2O的電離平衡常數Kb=1.75×105,H2CO3的電離平衡常數K1=4.4×10-7,K2=4.7×10-11,Kb>K2,所以碳酸氫根離子的水解程度大于銨根離子的水解程度,NH4HCO3溶液顯堿性;反應NH4++HCO3-+ H2O![]() NH3·H2O+H2CO3的平衡常數K=
NH3·H2O+H2CO3的平衡常數K=![]() =
= ![]() =1.3×10-3,故答案為:堿性;1.3×10-3;
=1.3×10-3,故答案為:堿性;1.3×10-3;
(4). 由圖可知,電解時二氧化碳在b極上得電子發生還原反應生成乙烯,電極反應式為2CO2+12H++12e-=C2H4+4H2O,因離子交換膜只允許氫離子通過,所以是陽離子交換膜,故答案為:2CO2+12H++12e-=C2H4+4H2O;陽。


科目:高中化學 來源: 題型:
【題目】某溫度下,在固定容積的密閉容器中,可逆反應A(g)+3B(g)![]() 2C(g)測得平衡時A、B、C物質的量之比為n(A):n(B):n(C)=1:1:2,若保持溫度不變,以1:1:2的物質的量之比再充入A、B和C,下列判斷中正確的是
2C(g)測得平衡時A、B、C物質的量之比為n(A):n(B):n(C)=1:1:2,若保持溫度不變,以1:1:2的物質的量之比再充入A、B和C,下列判斷中正確的是
A. 平衡不移動
B. 平衡向逆反應方向移動
C. 新平衡時各物質的濃度都比原平衡時增大
D. C的質量分數減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,對可逆反應3A(g) ![]() 2B(g) +C(g)的下列敘述中,能說明反應已達到平衡的是( )
2B(g) +C(g)的下列敘述中,能說明反應已達到平衡的是( )
A.C生成的速率與B分解的速率相等
B.單位時間內消耗3a mol A, 同時消耗生成a mol C
C.容器內的壓強不再變化
D.混合氣體的物質的量不再變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應A+3B==2C+4D(A、B、C、D均為氣態),在四種不同情況下的反應速率最快的是
A. v(A)=0.1mol/(L·s) B. v(B) =0.6mol/(L·s)
C. v(C) =0.6mol/(L·s) D. v(D) =0.8mol/(L·s)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙醇可以發生下列化學反應,在反應里乙醇分子斷裂碳氧鍵而失去羥基的是
A. 乙醇與金屬鈉反應 B. 乙醇與氫鹵酸的取代反應
C. 乙醇的催化氧化反應 D. 乙醇和乙酸的酯化反應
查看答案和解析>>
科目:高中化學 來源: 題型:
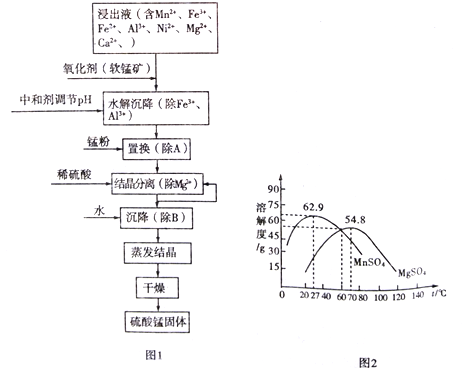
【題目】軟錳礦的主要成分是MnO2,其懸濁液可吸收煙氣中SO2,所得酸性浸出液又可用于制備高純硫酸錳,其一種工藝流程如下圖圖1所示。已知金屬單質的活動順序為Al>Mn>Fe>Ni。回答下列問題:
(1)用離子方程式表示加入“氧化劑(軟錳礦)”作用:_________________________。
(2)已知:Ksp[Al(OH)3]=1.0×10-33 Ksp[Ni(OH)2]=1.6×10-15
Ksp[Mn(OH)2]=4.0×10-14 Ksp[Fe(OH)3]=2.6×10-39
“水解沉降”中:
①“中和劑”可以是__________(填標號)。
A.Al2O3 B.MgO C.H2SO4 D.MnO2
②溶液的pH應不低于______________。(離子濃度小于1×10-6mol/L時,即可認為該離子沉淀完全)
(3)“置換”的目的是____________________(用離子方程式表示)。
(4)“結晶分離”中的部分物質的溶解度曲線如上圖圖2所示。結晶與過濾過程中,體系溫度均應維持在______________℃(填“27”、“60”或“70”)。
(5)“草酸鈉一高錳酸鉀返滴法”可測定軟錳礦中MnO2的純度(假設雜質不參與反應):取agMnO2樣品于錐形瓶中,加入適量稀硫酸,再加入V1mLc1 mol/LNa2C2O4溶液(足量),最后用c2mol/L的KMnO4溶液滴定剩余的Na2C2O4,達終點時消耗V2 mL標準KMnO4溶液。
①MnO2參與反應的離子方程式為________________________。
②該樣品中MnO2的質量分數為______(假定雜質不參與反應,列出表達式即可)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在照相底片的定影過程中,未曝光的溴化銀(AgBr)常用硫代硫酸鈉(Na2S2O3)溶解,反應生成Na3[Ag(S2O3)2];在廢定影液中加人Na2S使Na3[Ag(S2O3)2]中的銀轉化為Ag2S,并使定影液再生。將Ag2S在高溫下轉化為Ag,就達到了回收銀的目的。
(1)銅、銀、金在元素周期表中位于同一族相鄰周期,基態銀原子的最外層電子排布式為 _______。
(2)Na、O、S簡單離子半徑由大到小的順序為______________________。
(3)S2O32-離子結構如圖所示,其中心硫原子的雜化軌道類型為_______________________。

(4)寫出AgBr 溶于Na2S2O3溶液的離子反應方程式______________。Na3[Ag(S2O3)2]中存在的作用力有離子鍵、共價鍵、______________。
(5)在空氣中灼燒Ag2S生成Ag和SO2,SO2 分子中硫原子的價層電子對數為_________,其分子空間構型為______________。 SO2易溶于水,原因是________________________________。
(6)現在人們已經有多種方法來測定阿伏加德羅常數,X射線衍射法就是其中的一種,通過對金晶體的X 射線衍射圖象的分析,可以得出金晶體的晶胞屬于面心立方晶胞(與銅的晶胞相似)。若金原子的半徑為am,金的密度為ρg·cm-3,金的摩爾質量為Mg·mol -1,試通過這些數據列出計算阿伏加德羅常數的算式______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某興趣小組利用下列實驗裝置探究SO2的性質。
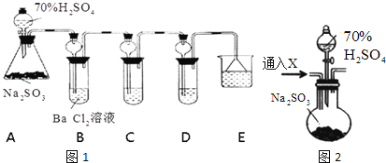
根據要求回答下列問題:
(1)裝置A中反應的化學方程式為__________________________________________。
(2)利用裝置C可以證明SO2具有漂白性,C中盛放的溶液是__________________。
(3)通過觀察D中現象,即可證明SO2具有氧化性,D中盛放的溶液可以是________。
A.NaCl溶液 B.酸性KMnO4 C.FeCl3 D.Na2S溶液
(4)研究小組發現B中有白色沉淀BaSO4生成,為進一步驗證B中產生沉淀的原因,研究小組進行如下兩次實驗:
實驗i:另取BaCl2溶液,加熱煮沸,冷卻后加入少量苯(起液封作用),然后再按照上述裝置進行實驗,結果發現B中沉淀量減少,但仍有輕微渾濁.
實驗ii:用如上圖2的F裝置代替上述實驗中的A裝置(其他裝置不變),連接后往裝置F中通入氣體X一段時間,再加入70%H2SO4溶液,結果B中沒有出現渾濁.
①“實驗i”中煮沸BaCl2溶液的目的是_______________________;
②氣體X可以是____________(填序號)。
A.CO2 B.C12 C.N2 D.NO2
③B中形成沉淀的原因是(用化學方程式表示):________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述不正確的是
A. 甲苯苯環上的一個氫原子被含3個碳原子的烷基取代,所得產物有6種
B. 分子式符合C5H11Cl的化合物有6種
C. 已知二氯苯有3種同分異構體,則四氯苯的同分異構體的數目為3
D. 菲的結構簡式為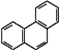 ,它與硝酸反應,可生成5種一硝基取代物
,它與硝酸反應,可生成5種一硝基取代物
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com