
【題目】為減小和消除過量CO2對環境的影響,一方面世界各國都在限制其排放量,另一方面科學家加強了對CO2創新利用的研究。
(1)最近有科學家提出“綠色自由”構想:先把空氣吹入飽和碳酸鉀溶液,然后再把CO2從溶液中提取出來,并使之變為可再生燃料甲醇。“綠色自由”構想技術流程如下:
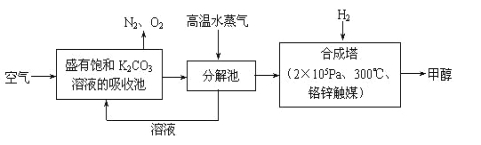
寫出分解池中反應的化學方程式 。在合成塔中,當有4.4 kg CO2與足量H2完全反應,可放出熱量4947 kJ,寫出合成塔中反應的熱化學方程式 。
(2)以CO2為碳源還可以制備乙醇,反應如下:
2CO2(g) + 6H2(g)=== CH3CH2OH(g) + 3H2O(g) △H=-173.6kJ/mol
寫出由CH3OH(g)合成CH3CH2OH(g)的反應的熱化學方程式 。
(3)某實驗小組依據甲醇燃燒的反應原理,設計如圖所示的電池裝置。

①該電池正極的電極反應為 。
②工作一段時間后,測得溶液的pH減小,該電池總反應的化學方程式為 。當電子轉移 mol時,參加反應的氧氣的體積是6.72L(標準狀況下)。
(4)以甲醇為燃料還可制作新型燃料電池,電池的正極通入O2,負極通入甲醇,用熔融金屬氧化物MO作電解質(可傳導O2-)。該電池負極發生的電極反應是 。
【答案】(1)2KHCO3![]() K2CO3+H2O+CO2↑(2分)
K2CO3+H2O+CO2↑(2分)
CO2(g)+3H2(g)===CH3OH(g)+H2O(g)△H=-49.47kJ/mol(2分)
(2)2CH3OH(g)===CH3CH2OH(g)+H2O(g)△H=-74.66kJ/mol(2分)
(3)①O2+2H2O+4e-===4OH-(2分)
②2CH3OH+3O2+4OH-===2CO32-+6H2O(2分);1.2mol(2分)
(4)CH3OH-6e-+3O2-===CO2+2H2O(2分)
【解析】
試題分析:(1)分解池中反應的化學方程式為2KHCO3![]() K2CO3+H2O+CO2↑;根據4.4 kg CO2與足量H2恰好完全反應,可放出4947 kJ的熱量,則1 mol CO2與氫氣合成甲醇放出熱量49.47 kJ的熱量,所以熱化學方程式為CO2(g)+3H2(g)===CH3OH(g)+H2O(g) △H=-49.47kJ/mol;
K2CO3+H2O+CO2↑;根據4.4 kg CO2與足量H2恰好完全反應,可放出4947 kJ的熱量,則1 mol CO2與氫氣合成甲醇放出熱量49.47 kJ的熱量,所以熱化學方程式為CO2(g)+3H2(g)===CH3OH(g)+H2O(g) △H=-49.47kJ/mol;
(2)2CO2(g) + 6H2(g)=== CH3CH2OH(g) + 3H2O(g) △H=-173.6kJ/mol,根據蓋斯定律,對(1)中方程式乘以2然后用該方程式減去(1),可以得到CH3OH(g)合成CH3CH2OH(g)的反應的熱化學方程式為2CH3OH(g) ===CH3CH2OH(g)+ H2O(g) △H=-74.66kJ/mol。
(3)①在甲醇燃料電池中,氧氣在正極上被還原,在堿性條件下生成水,電池正極電極反應式為 O2 +2H2O+4e-=== 4OH-。
②工作一段時間后,測得溶液的pH減小,則該電池總反應的化學方程式為2CH3OH + 3O2 + 4OH- === 2CO32- + 6H2O。參加反應的氧氣的體積是6.72L(標準狀況下),物質的量是0.3mol,轉移電子物質的量為1.2mol。
(4)甲醇在負極失去電子,該電池負極發生的電極反應是CH3OH-6e-+3O2-=== CO2+2H2O。


科目:高中化學 來源: 題型:
【題目】下列對分子或離子的立體構型判斷不正確的是 ( )。
A.NH4+和CH4都是正四面體形
B.CO2和CS2都是直線形
C.NCl3和BCl3都是三角錐形
D.H2O和H2S都是V形
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】含硫物質燃燒會產生大量煙氣,主要成分是SO2、CO2、N2和O2。某研究性學習小組在實驗室利用下列裝置制備模擬煙氣,并測算模擬煙氣通過轉化器的脫硫效率。
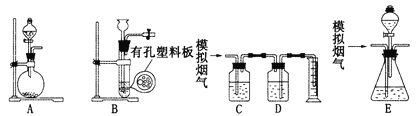
回答下列問題:
I.模擬煙氣的制備
(1)用A裝置制SO2的化學方程式為______________________________。
(2)用B裝置制CO2,使用該裝置的優點是___________________________。
(3)將制得的氣體與空氣充分混合,獲得模擬煙氣用于后續實驗。
Ⅱ.測定煙氣中SO2的體積分數
(4)將部分模擬煙氣緩慢通過C、D裝置,C、D中盛放的藥品分別是____、____(填序號):
①KMnO4溶液②飽和NaHSO3溶液③飽和Na2CO3溶液④飽和NaHCO3溶液
(5)若模擬煙氣的流速為a mL·min-1,t1 min后,測得量筒內液體的體積為V mL則SO2的體積分數是_______________(寫表達式)。
III.測算模擬煙氣通過轉化器的脫硫效率(已轉化的SO2占原有SO2的百分比)
(6)將模擬煙氣通過轉化器E裝置,E裝置中盛有FeC12和FeCl3的混合溶液,常溫下,它可催化SO2與O2的反應,以達到脫硫的目的。寫出催化劑參與反應過程的離子方程式:
①SO2+2H2O+2Fe3+==SO42-+2Fe2++4H+;②______________________________。
(7)若模擬煙氣仍以a mL· min-1的流速直接通過轉化器E裝置,t2 min后,向E裝置中加入足量的鹽酸酸化的BaCl2溶液得到白色渾濁液,經_______、 洗滌、_____、稱量,得到m g固體。若實驗的氣體體積已折算為標準狀況,則該轉化器的脫硫效率是_________________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知咖啡酸的結構如圖所示。關于咖啡酸的描述正確的是:(______)
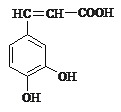
A.分子式為C9H5O4
B.1 mol 咖啡酸最多可與5 mol 氫氣發生加成反應
C.與溴水既能發生取代反應,又能發生加成反應
D.1 mol 咖啡酸最多可與3 mol Na2CO3發生反應
(2)A、B、C、D1、D2、E、F、G、H均為有機化合物,請根據下列圖示回答問題。
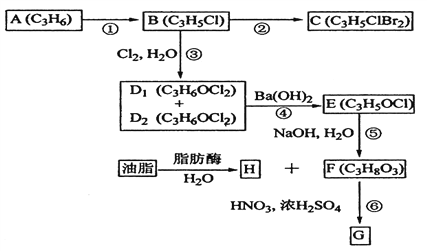
(1)直鏈有機化合物A的結構簡式是__________________;
(2)B中官能團的名稱為___________,H中含氧官能團的結構簡式為____________;
(3)①的反應試劑和反應條件是___________________,③的反應類型是_____________;
(4)B生成C的化學方程式是___________________;
D1或D2生成E的化學方程式是___________________;
(5)G可應用于醫療、爆破等,由F生成G的化學方程式是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室有兩瓶失去標簽的溶液,其中一瓶是K2SO4溶液,另一瓶是NaOH溶液.鑒別時,下列選用的試紙或試劑不正確的是( )
A.pH試紙
B.紫色石蕊試液
C.Na2CO3固體
D.CuCl2溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知一氧化碳與水蒸氣的反應為: CO(g) + H2O(g)![]() CO2(g) + H2(g)
CO2(g) + H2(g)
在427 ℃ 時的平衡常數是9。如果反應開始時,一氧化碳和水蒸氣的濃度都是0. 01 mol/L,則一氧化碳在此反應條件下的轉化率為___________。
(2)規律是對經常出現的客觀現象的歸納。規律越普遍,適用性或預言性也就越強,然而,任何規律都有其適用范圍。
① 某同學在實驗中發現,將H2S氣體通入CuSO4溶液中,生成了黑色沉淀。請寫出反應的化學方程式 ____________。
② 酸性強弱除與物質的本性有關外,還與溶劑有關,如CH3COOH與HF在液氨中可完全電離。在液氨中,反應CH3COONa + HCl = NaCl + CH3COOH _______(填“能”或“不能”)發生,理由是______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于元素周期表,下列敘述中不正確的是( )。
A.在金屬元素與非金屬元素的分界線附近可以尋找制備半導體材料的元素
B.在過渡元素中可以尋找制備催化劑及耐高溫和耐腐蝕的元素
C.在金屬元素區域可以尋找制備新型農藥材料的元素
D.周期表中位置靠近的元素性質相近
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在通常條件下,下列各組物質的性質排列正確的是( )
A.熔點:Na>MgO>SiO2
B.水溶性:SO2>H2S>HCl
C.熱穩定性:HF>H2O>NH3
D.沸點:HF>HCl>HBr
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】MnO2是常見的氧化劑、催化劑和活性電極材料。
(1)工業上,以惰性材料為電極,電解MaSO4溶液(含少量稀硫酸)制備MnO2。寫出陽極的電極反應式:_________________________________。
(2)已知如下熱化學方程式(K代表平衡常數):
①MnCO3(s)![]() Mn0(s)+CO2(g)△H1 K1
Mn0(s)+CO2(g)△H1 K1
②2MnO(s)+O2(g)![]() 2MnO2(s)△H2 K2
2MnO2(s)△H2 K2
③2MnCO3(n)+O2(g)![]() 2MnO2(s)+2CO2(g)△H3 K3
2MnO2(s)+2CO2(g)△H3 K3
△H3=________用△H1,△H2表示);K3=________用K1、K2表示)。
(3)反應②在低溫條件下能自發進行,則△H3________0(填“>"“<"或“=")。
(4)在密閉容器中投入足量的MnCO3,一定條件下發生反應MnCO3(s)![]() MnO(s)+CO2(g) △H>0。在一定濕度下,達到平衡狀態時ρ(CO2)=2aMPa。
MnO(s)+CO2(g) △H>0。在一定濕度下,達到平衡狀態時ρ(CO2)=2aMPa。
①溫度、壓強對MnCO3分解率的影響如圖所示:
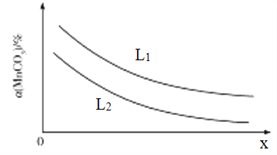
比較:L1__________L2(填“>"“<”或“=")。
②保持溫度不變,將容器休積擴大至原來的2倍,則ρ(CO2)的變化范圍是____________。
③保持溫度不變,將容器體積壓縮至原來的一半,達到新平衡時下列物理量一定不變的是____(填代號)。
A.平衡常數K B.c(CO2) C.n(CO2) D.m(MnCO3)
(5)一定溫度下,在容積為2L的恒容密閉容器中加入足量的MnCO3(s)和5molO2,發生反應:2MnCO3(s)+O2(g)![]() 2MnO2(s)+2CO2(g),CO2以平均速率為0.1mol·L-1·min-1經過10min達到平衡狀態,該條件下該反應的平衡常數K為______________。
2MnO2(s)+2CO2(g),CO2以平均速率為0.1mol·L-1·min-1經過10min達到平衡狀態,該條件下該反應的平衡常數K為______________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com