
【題目】如圖在襯白紙的玻璃片中央放置適量的KMnO4顆粒,在周圍分別滴加一滴含有酚酞的澄清石灰水、FeCl2溶液,然后在KMnO4晶體上滴加適量的濃鹽酸,迅速蓋好表面皿。提示:實驗室中所用的少量氯氣可以用下述原理制取:2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8H2O,此反應在常溫下即能進行。
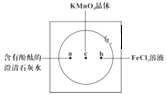
(1)濃鹽酸在反應中表現出來的性質是______ (填寫編號),氧化劑與還原劑物質的量之比為______ ,氧化產物為______ 。
①只有還原性 ②還原性和酸性
③只有氧化性 ④氧化性和酸性
(2)產生0.1 mol Cl2,則轉移電子的物質的量為 ______ mol。
(3)a處反應的化學方程式是___________________________,工業上用此原理制取漂白粉。
(4)b處離子方程式是________________________。
(5)高錳酸鉀標準溶液經常用來滴定測量物質的含量。用高錳酸鉀法間接測定石灰石中CaCO3的含量的方法為:稱取試樣0.1250g,用稀鹽酸溶解后加入(NH4)2C2O4得CaC2O4沉淀。沉淀經過濾洗滌后溶于稀硫酸中。滴定生成的H2C2O4用去濃度為0.016mo/LKMnO4溶液25.00mL。
①寫出CaC2O4沉淀溶解的離子方程式:___________________
②配平并完成下列高錳酸鉀滴定草酸反應的離子方程式: ____MnO4-+___H2C2O4+____=___Mn2++___CO2↑+____
③石灰石中CaCO3的百分含量:_______
【答案】② 1:5 Cl2 0.2 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 2Fe2++Cl2=2Fe3++2Cl CaC2O4+2H+=Ca2++H2C2O4 2 5 6 2 10 8H2O 80%
【解析】
(1)根據反應:2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8H2O可得,反應中生成KCl、MnCl2,鹽酸顯示酸性,生成Cl2,氯元素化合價升高,做還原劑,氧化產物為Cl2,鹽酸顯示還原性。KMnO4中Mn化合價降低,做氧化劑。氧化劑與還原劑物質的量之比=2:10=1:5;
答案為:②;1:5;Cl2;
(2)根據反應方程式,生成5 mol Cl2,轉移10 mol電子,現產生0.1 mol Cl2,轉移電子0.2 mol電子;
答案為:0.2
(3)a處Cl2和Ca(OH)2反應,化學方程式:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
答案為:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(4)b處Cl2和氯化亞鐵反應,可氧化亞鐵離子,溶液由淺綠色變為黃色,離子方程式:2Fe2++Cl2=2Fe3++2Cl;
答案為:2Fe2++Cl2=2Fe3++2Cl;
(5)①草酸鈣與鹽酸發生復分解反應生成草酸和氯化鈣,反應的離子方程式:CaC2O4+2H+=Ca2++H2C2O4;
故答案為:CaC2O4+2H+=Ca2++H2C2O4;
②根據元素守恒知,生成物中還含有水,該反應中Mn元素化合價由+7價變為+2價、C元素化合價由+3價變為+4價,其轉移電子總數為10,所以MnO4、H2C2O4的計量數分別是2、5,再結合原子守恒配平方程式為2MnO4+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案為:2;5;6;2;10;8;
③依據題意可知:CaCO3CaC2O4H2C2O4![]() MnO4,
MnO4,
則:CaCO3![]() MnO4,
MnO4,
100g 0.4mol
m(CaCO3) 0.016mo/L×0.025L
解得:m(CaCO3)=0.1g,
則碳酸鈣的含量為:![]() =80%;
=80%;
故答案為:80%。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】某無色溶液X,由K+、NH4+、Ba2+、Al3+、Fe3+、CO32-、SO42-中的若干離子組成,取該溶液進行如下實驗:

(1)白色沉淀甲是___;
(2)試寫出實驗過程中生成氣體A、B的離子方程式___;
(3)通過上述實驗,可確定X溶液中一定存在的陰離子是___;尚未確定是否存在的離子是___;
(4)若要檢驗溶液中是否含有CO32-離子,其方法是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三種氣體X、Y、Z的相對分子質量關系為Mr(X)<Mr(Y)=0.5Mr(Z),下列說法正確的是
A. 原子數目相等的三種氣體,質量最大的是Z
B. 同溫同壓下,同質量的三種氣體,氣體密度最小的是X
C. 若一定條件下,三種氣體體積均為2.24 L,則它們的物質的量一定均為0.1 mol
D. 同溫下,體積相同的兩容器分別充2 g Y氣體和1 g Z氣體,則其壓強比為2︰1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】苯和溴的取代反應的實驗裝置如圖所示,其中A為具支試管改制成的反應容器,在其下端開了一小孔,塞好石棉絨,再加入少量鐵屑。
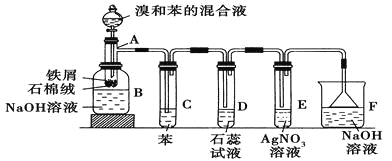
填寫下列空白:
(1)向反應容器A中逐滴加入溴和苯的混合液,幾秒鐘內就發生反應。寫出A中所發生反應的化學方程式(有機物寫結構簡式):________________________。
(2)試管C中苯的作用是 。反應開始后,觀察D和E兩試管,看到的現象分別為 、 。
(3)反應2~3 min后,在B中的NaOH溶液里可觀察到的現象是 。
(4)在上述整套裝置中具有防倒吸作用的儀器有 (填字母)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】孔雀石主要含Cu2(OH)2CO3,還含少量Fe、Si的化合物。某工廠以孔雀石為主要原料制備CuSO4·5H2O,主要步驟如下:
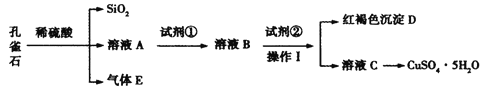
已知該條件下,通過調節溶液的酸堿性而使 Fe3+、Fe2+、Cu2+生成沉淀的 pH 分別如下:
物質 | 開始沉淀時的pH | 完全沉淀時的pH |
Fe(OH)3 | 2.2 | 3.2 |
Fe(OH)2 | 7.6 | 9.6 |
Cu(OH)2 | 4.7 | 6.4 |
請回答下列問題:
(1)為了提高孔雀石酸浸時的速率,除適當增加濃硫酸濃度外,還可以采取的措施有:___(寫一種)。
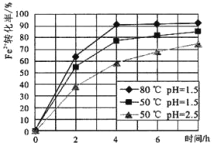
(2)試劑①是雙氧水,把 Fe2+氧化成 Fe3+的目的是___。根據如圖有關數據,你認為工業上氧化操作時應采取的條件是___。
(3)試劑②為CuO,其目的是調節溶液的 pH 保持在___范圍。操作Ⅰ的名稱是___。
(4)溶液 C 得到CuSO4·5H2O的主要步驟是___、___、過濾、洗滌、干燥。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上電解 Na2CO3的原理如圖所示。下列說法不正確的是( )

A. 陰極產生的物質 A 是 H2
B. 電解一段時間后,陽極附近溶液的 PH 將增大
C. 該離子交換膜應為陽離子交換膜
D. 陽極電極反應為 4CO32-+2H2O-4e-=4HCO3-+O2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一般較強酸可制取較弱酸,這是復分解反應的規律之一。已知在常溫下測得濃度均為0.1mol/L的下列 3 種溶液的 pH:
溶質 | NaHCO3 | Na2CO3 | NaClO |
pH | 8.34 | 11.6 | 10.3 |
下列有關說法正確的是( )
A. 以上溶液的 pH 是用廣泛 pH 試紙測定的
B. 反應CO2+H2O+2NaClO=Na2CO3+2HClO可以發生
C. 室溫下,電離常數: K2( H2CO3)>K( HClO)
D. 在新制氯水中加入少量 NaHCO3固體可以提高溶液中 HClO 的濃度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CuCl和CuCl2都是重要的化工原料,常用作催化劑、顏料、防腐劑和消毒劑等。
已知:①CuCl可以由CuCl2用適當的還原劑如SO2,SnCl2等還原制得:2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液與乙二胺(H2N—CH2—CH2—NH2)可形成配離子:
2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液與乙二胺(H2N—CH2—CH2—NH2)可形成配離子:  。
。
請回答下列問題:
(1)基態Cu原子的核外電子排布式為_____;H、N、O三種元素的電負性由大到小的順序是____。
(2)SO2分子的空間構型為________;與SnCl4互為等電子體的一種離子的化學式為________。
(3)乙二胺分子中氮原子軌道的雜化類型為________。乙二胺和三甲胺[N(CH3)3]均屬于胺,但乙二胺比三甲胺的沸點高得多,原因是__________。
(4)②中所形成的配離子中含有的化學鍵類型有______(填字母)。
A.配位鍵 B.極性鍵 C.離子鍵 D.非極性鍵
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com