
【題目】鹵素單質可以參與很多化學反應, 如:NF3氣體可由NH3和F2在Cu催化劑存在下反應直接得到;反應①:2NH3+3F2![]() NF3+ 3NH4F,Ta(鉭)是一種過渡元素,利用“化學蒸氣轉移法”可以制備TaS2晶體;反應②:TaI4(g)+S2(g)
NF3+ 3NH4F,Ta(鉭)是一種過渡元素,利用“化學蒸氣轉移法”可以制備TaS2晶體;反應②:TaI4(g)+S2(g)![]() TaS2(s)+2I2(g)+QkJ,Q>0
TaS2(s)+2I2(g)+QkJ,Q>0
(1)反應①中:非金屬性最強的元素原子核外有____種不同運動狀態的電子;該反應中的某元素的單質可作糧食保護氣,則該元素最外層的電子有___種自旋方向。
(2)反應①中:物質所屬的晶體類型有____;并寫出所有原子符合8電子穩定結構的化合物的電子式____。
(3)反應②中:平衡常數表達式:K=___,若反應達到平衡后,保持其他條件不變,降低溫度,重新達到平衡時____。
a.平衡常數K增大 b. S2的濃度減小 c. I2的質量減小 d. V(TaI4)逆 增大
(4)反應②在一定溫度下進行,若反應容器的容積為2L,3min后達到平衡,測得蒸氣的質量減少了2.45g,則I2的平均反應速率為___。
(5)某同學對反應②又進行研究,他查閱資料,發現硫單質有多種同素異形體,可表示Sx(x為偶數),且在一定條件下可以相互轉化,他認為僅增大壓強對平衡是有影響的,則TaI4的平衡轉化率會____(填增大或減小),其原因是___。
【答案】9 2 分子晶體、金屬晶體、離子晶體 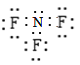 [I2]2/[TaI4][S2] ab 0.00333mol/(Lmin)或1/300 mol/(Lmin) 平衡轉化率會減小 原因是在S2可以轉化為S4或S6或S8+,2TaI4(g)+S4(g)
[I2]2/[TaI4][S2] ab 0.00333mol/(Lmin)或1/300 mol/(Lmin) 平衡轉化率會減小 原因是在S2可以轉化為S4或S6或S8+,2TaI4(g)+S4(g)![]() 2TaS2(s)+4I2(g)加壓使平衡向逆反應方向進行
2TaS2(s)+4I2(g)加壓使平衡向逆反應方向進行
【解析】
(1)反應①中:非金屬性最強的元素是F,原子中沒有運動狀態相同的電子,核外有幾個電子就有幾種不同運動狀態的電子;氮氣可作糧食保護氣,最外層有5個電子,電子的自旋方向有2種;
(2)根據共價物質的組成分析晶體的類型;對于ABn的共價化合物,各元素滿足|化合價|+元素原子的最外層電子數=8,原子都滿足最外層8電子結構;,然后書寫電子式;
(3)平衡常數為產物濃度系數次冪的乘積與反應物濃度系數次冪的乘積的比值;該反應為放熱反應,降低溫度,平衡正向移動;
(4)反應容器的容積為2L,3min后達到平衡,測得蒸氣的質量減少了2.45g,依據化學方程式的氣體質量變化計算反應I2物質的量,依據化學反應速率概念計算;
(5)根據S2會轉變成S4、S6、S8,反應物氣體的物質的量偏小。
(1)反應①中:非金屬性最強的元素是F,F原子中有9個電子,就有9種不同運動狀態的電子;氮氣可作糧食保護氣,最外層有5個電子,電子的自旋方向有2種;
(2)NH3、F2、NF3屬于分子晶體,NH4F屬于離子晶體,Cu屬于金屬晶體;NF3中N元素化合價為+3,N原子最外層電子數為5,所以3+5=8,分子中N原子滿足8電子結構;F元素化合價為-1,F原子最外層電子數為7,所以|-1|+7=8,分子中F原子滿足8電子結構,電子是為: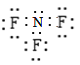 ;
;
(3)反應TaI4(g)+S2(g)![]() TaS2(s)+2I2(g)體系中,平衡常數為產物濃度系數次冪的乘積與反應物濃度系數次冪的乘積的比值,K=
TaS2(s)+2I2(g)體系中,平衡常數為產物濃度系數次冪的乘積與反應物濃度系數次冪的乘積的比值,K=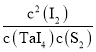 ;該反應為放熱反應,降低溫度,平衡正向移動;
;該反應為放熱反應,降低溫度,平衡正向移動;
a.降低溫度,平衡正向移動,平衡常數K增大,故a正確;
b.平衡正向移動,S2的濃度減小,故b正確;
c.平衡正向移動,I2的質量增大,故c錯誤;
d.溫度降低,V(TaI4)逆減小,故d錯誤;
故答案為:ab;
(4)若反應容器的容積為2L,3min后達到平衡,測得蒸氣的質量減少了2.45g,則
TaI4(g)+S2(g)![]() TaS2(s)+2I2(g) △m
TaS2(s)+2I2(g) △m
2mol 245g
0.02mol 2.45g
生成的I2為0.02mol,則I2的平均反應速率= =0.00333mol/(Lmin);
=0.00333mol/(Lmin);
(5)S2會轉變成S4或S6或S8,反應物氣體的物質的量偏小,所以增大壓強,平衡逆向移動,TaI4的平衡轉化率減小。


科目:高中化學 來源: 題型:
【題目】(I)有下列幾組物質或原子:①612C和614C②H③Na2O2④P⑤N⑥H2⑦O2和O3⑧燒堿、純堿及苛性鈉。選擇適當的序號回答有關問題:
(1)屬于第二周期ⅤA族的元素是_____________;
(2)含有非極性鍵的離子化合物是_____________;
(3)互為同位素的是_____________;
(4)原子半徑最小的原子形成的分子是_____________;
(5)屬于同素異形體的是_____________。
(II)用合理的化學用語回答下列問題
(1)甲烷分子的電子式:_____________;
(2)乙烯分子的結構簡式:_____________;
(3)甲烷和氯氣光照生成一氯甲烷方程式:_____________;
(4)苯和液溴在鐵屑催化下反應生成溴苯方程式:_____________;
(5)乙醇和金屬鈉反應生成乙醇鈉方程式:_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素X、Y、Z、W原子序數依次增大。X氫化物的水溶性顯堿性;Y在元素周期表中所處的周期序數與族序數相等;Z單質是將太陽能轉化為電能的常用材料,也是一種半導體材料;W是重要的“成鹽元素”,主要以鈉鹽的形式存在于海水中。請回答:
(1)Y在元素周期表中的位置是________。
(2)Y的最高氧化物相應水化物具有______(填“酸性”、“堿性”、“兩性”)。并寫出其電離方程式______。
(3)X氫化物的水溶液與W氫化物的水溶液混合后恰好反應時,溶液呈__性(填“酸”、“堿”或“中”),用離子方程式表示其原因是__。
(4)Z和W比較,非金屬性較弱的是_______(填元素符號)。下列可以驗證這一結論的是_______(填序號)。
a.元素在地殼中的含量
b.最高價氧化物對應水化物的酸性
c.氫化物的水溶性
d.Z與W以共價鍵形成化合物時,Z或W顯示的化合價
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據有機化合物的命名原則,下列命名正確的是
A.![]() 3-甲基-1,3-丁二烯
3-甲基-1,3-丁二烯
B.![]() 2-羥基丁烷
2-羥基丁烷
C.CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷
D.(CH3)3CCl 2-甲基-2-氯丙烷
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用如圖所示裝置進行下列實驗,能得到相應實驗結論的是( )

選項 | ① | ② | ③ | 實驗結論 |
A | 濃硫酸 | Na2SO3 | 酸性KMnO4溶液褪色 | SO2有漂白性 |
B | 濃硫酸 | Cu | 品紅溶液 | SO2具有漂白性 |
C | 稀鹽酸 | 碳酸鈉 | 氯化鈣溶液 | CO2與CaCl2不反應 |
D | 濃硫酸 | 蔗糖 | 溴水褪色 | 濃硫酸具有脫水性、吸水性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以乙烯與甲苯為主要原料,按下列路線合成一種香料W:
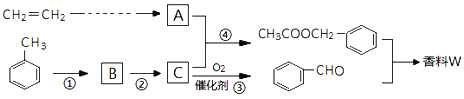
(1)實驗室制備乙烯的反應試劑與具體反應條件為____。
(2)上述①~④反應中,屬于取代反應的是___。
(3)檢驗反應③是否發生的方法是____。
(4)寫出兩種滿足下列條件的![]() 同分異構體的結構簡式。____、____。
同分異構體的結構簡式。____、____。
a.能發生銀鏡反應 b.苯環上的一溴代物有兩種
(5)設計一條由乙烯制備A的合成路線。(無機試劑可以任選)____。
(合成路線常用的表示方式為: )
)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙烯催化氧化成乙醛可設計成如下圖所示的燃料電池,能在制備乙醛的同時獲得電能,其總反應為:2CH2=CH2+O2→2CH3CHO。下列有關說法正確的是
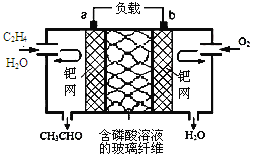
A.a電極發生還原反應
B.放電時,每轉移2mol電子,理論上需要消耗28g乙烯
C.b極反應式為:O2+4e-+2H2O=4OH-
D.電子移動方向:電極a→磷酸溶液→電極b
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)純堿是一種重要的化工原料。目前制堿工業主要有“氨堿法”和“聯合制堿法”兩種工藝。
①“氨堿法”產生大量CaCl2廢棄物,寫出該工藝中產生CaCl2的化學方程式:___;
②CO2是制堿工業的重要原料,“聯合制堿法”與“氨堿法”中CO2的來源有何不同?___;
(2)某探究活動小組根據上述制堿原理,進行碳酸氫鈉的制備實驗,同學們按各自設計的方案實驗.①一位同學將二氧化碳氣體通入含氨的飽和食鹽水中制備碳酸氫鈉,實驗裝置如圖所示(圖中夾持、固定用的儀器未畫出)試回答下列有關問題:
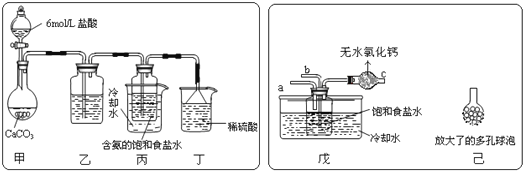
(Ⅰ)乙裝置中的試劑是___;其作用是____;
(Ⅱ)丁裝置中稀硫酸的作用是___;
(Ⅲ)實驗結束后,分離出NaHCO3晶體的操作是___(填分離操作的名稱).該操作所需是玻璃儀器有____。
②另一位同學用圖中戊裝置(其它裝置未畫出)進行實驗。
(Ⅰ)實驗時,須先從__(“a”或“b”)管通入___氣體,說明原因___。
(Ⅱ)有同學建議在戊裝置的b管下端連接己裝置,理由是___。
(III)碳酸氫鈉受熱所得固體12.28g與足量石灰水充分反應,所得沉淀經洗滌、干燥質量為12.00g,則所得固體中碳酸鈉的質量分數為:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列中心原子的雜化軌道類型和分子立體構型不正確的是( )
A. PCl3中P原子采用sp3雜化,為三角錐形
B. BCl3中B原子采用sp2雜化,為平面三角形
C. CS2中C原子采用sp雜化,為直線形
D. H2S中S原子采用sp雜化,為直線形
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com