
【題目】硝酸汞和碘化鉀溶液混合后會生成紅色的碘化汞沉淀,為了探究硝酸汞和碘化鉀溶液之間能否發生氧化還原反應,研究人員設計了如圖的實驗裝置,結果電流計指針發生了偏轉,下列分析不正確的是
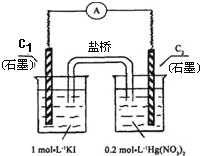
A. 如圖裝置的電流方向是從C2到C1
B. C1附近加入淀粉變藍,C2析出固體
C. 可用飽和KI溶液—瓊脂填充鹽橋增強導電性
D. 該裝置內發生的氧化還原反應可自發進行
【答案】C
【解析】
電流計指針發生了偏轉,說明有電流形成,證明形成了原電池反應,碘離子具有還原性,C1做負極,失電子生成碘單質,電極反應為2I--2e-═I2;C2做正極,溶液中汞離子得到電子發生還原反應,電流方向是從正極流向負極,據此答題。
A.分析可知C1為負極,C2為正極,電流是從正極C2流向負極C1,故A正確;
B.碘離子具有還原性,C1做負極,失電子生成碘單質,電極反應為2I--2e-═I2,加入淀粉變藍;C2做正極,溶液中汞離子得到電子發生還原反應,生成碘化亞汞,析出固體,故B正確;
C.飽和KI溶液—瓊脂鹽橋中的I-與Ag+、Hg2+發生反應,故不能使用,C錯誤;
D.該裝置為原電池,原電池反應都是自發發生的氧化還原反應,故D正確。
故選C。


 一線名師權威作業本系列答案
一線名師權威作業本系列答案科目:高中化學 來源: 題型:
【題目】利用水鈷礦[主要成分為Co2O3和Co(OH)3,還有少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工藝流程如圖所示:
 已知:①浸出液含有的陽離子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:
已知:①浸出液含有的陽離子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:
②部分陽離子以氫氧化物形式沉淀時溶液的pH見下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
開始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)寫出浸出過程中Co2O3發生反應的離子方程式__________________________。
(2)NaClO3的作用是___________________________________。
(3)加Na2CO3調pH至5.2所得沉淀為____________________________。
(4)萃取劑對金屬離子的萃取率與pH的關系如圖所示。萃取劑的作用是_____;其使用的適宜pH范圍是_____(填字母)。

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)有200mLMgCl2和AlCl3的混合溶液,其中c(Mg2+)為0.2moI·L-1,c(Cl-)為1.3mol·L-1,要使Mg2+完全轉化為沉淀分離出來,至少需要加4mol·L-1 NaOH溶液的體積為___mL。
(2)某溶液中只含有Na+,Al3+,Cl-,SO42-四種離子,已知前三種離子的個數比為3∶2∶1,則溶液中Al3+和 SO42-的離子個數比為___。
(3)5.85gNaCl和xgMgCl2一起溶于水配成1L溶液,測得Cl-物質的量濃度為0.3mol·L-1,則x的值為___g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于Zn+H2SO4→ZnSO4+H2↑+Q的化學反應,下列敘述不正確的是
A.反應過程中能量關系如圖所示
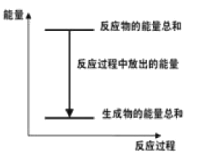
B.Q的值與反應的計量系數有關
C.若將反應設計成原電池鋅為負極
D.若將其設計為原電池,當有32.5g鋅溶解,正極放出的氣體一定為11.2L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列屬于放熱反應的是
A. C + CO2![]() 2CO
2CO
B. CaCO3![]() CaO + CO2↑
CaO + CO2↑
C. 2Al + Fe2O3![]() 2Fe + Al2O3
2Fe + Al2O3
D. Ba(OH)2·8H2O + 2NH4Cl=BaCl2 + 2NH3↑+ 10H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】苯甲酸(C6 H 5COOH)是一種重要的化工原料,廣泛應用于制藥和化工行業。某化學小組用甲苯作主要原料制備苯甲酸的步驟如下:
步驟一:在如圖甲所示裝置的三頸瓶中加入2.7mL甲苯(2.3g)、100mL水和2~3片碎瓷片,開動電動攪拌器,a中通入流動的水,在石棉網上加熱至沸騰,然后分批加人8.5g高錳酸鉀,在100℃時,繼續攪拌約4~5h,再停止反應。

步驟二:將反應后的混合液過濾,濾液用濃鹽酸酸化后用圖乙所示的裝置抽濾得粗產品。
步驟三:將粗產品進行重結晶即得純品苯甲酸。
甲苯、苯甲酸鉀、苯甲酸的部分物理性質見下表:

(1)儀器A的名稱為___________,其出水口是___________(填“a”或“b”)。
(2)步驟一中,應在三頸瓶中觀察到_________________________________的現象時才停正反應。
(3)反應結束時,測得三頸瓶中混合液為堿性,則三頸瓶內發生反應的化學方程式為_________________________________(在本實驗條件下,高錳酸鉀的還原產物是MnO2)
(4)步驟二中抽濾的優點是____________________________________________。
(5)如圖乙所示抽濾完畢時,應先斷開______________________之間的橡皮管。
(6)步驟二中,如果濾液呈紫色,要先加KHSO3,原因是______________________。
(7)若提純得到2.9g苯甲酸,則甲酸的產率是___________%。(保留到小數點后一位)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】市售“家用消毒液發生器”是以精鹽和自來水為原料,通過時發生器內的電極板上產生大量氣泡(同時使產生的氣體充分與電解液接觸),所制得的混合液具有強烈的殺菌能力,且不致對人體造成傷害,該發生器配制消毒液所涉及到的化學反應有
(1)2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(2)Cl2+2NaOH→NaCl+NaClO+H2O
(3)H2+Cl2 ![]() 2HCl
2HCl
(4)Cl2+H2O→HCl+HClO
(5)2HClO ![]() 2HCl+O2↑
2HCl+O2↑
A.(1)(4)(5)B.(1)(2)
C.(3)(4)(5)D.(2)(3)(4)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某“84”消毒液瓶體部分標簽如圖所示,該“84 消毒液通常稀釋100 倍(體積之比)后使用。請回答下列問題:

(1)“84消毒液的物質的量濃度約為_______(保留一位小數molL-1)
(2)某同學取20mL該“84"消毒液,稀釋后用于消毒,稀釋后的溶液中c(Na+)=______mol
(3)“84”消毒液與稀硫酸混合使用可增強消毒能力,某消毒小組人員用98%(密度為1.8gcm-3)的濃硫酸配制1L3.6mo1L-1稀硫酸用于增強“84”消毒液的消毒能力。需用濃硫酸的體積為______mL;配制該溶液需要的儀器有玻璃棒、燒杯、量筒和_______(填玻璃儀器名稱)
(4)若配制3.6mol/L的硫酸溶液的其他操作均正確,但出現下列錯誤操作,將使 所配制的硫酸溶液濃度偏低的是_______(填字母代號,多選題,少選不給分)
A.將稀釋的硫酸溶液轉移至容量瓶后,未洗滌燒杯和玻璃棒
B.稀釋過程中,溶液未經冷卻就轉移至容量瓶
C.所用濃硫酸長時間放置在密封不好的容器中
D.用膠頭滴管向容量瓶中加水時,俯視觀察溶液凹液面與容量瓶刻度相切
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在恒容密閉容器中發生反應2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)。在323K和343K時SiHCl3的轉化率隨時間變化的結果如圖所示。下列說法正確的是( )

A. 323 K時,縮小容器體積可提高SiHCl3的轉化率
B. a、b點對應的反應速率大小關系:v(a)<v(b)
C. 343 K時,上述反應的化學平衡常數約為0.02
D. 2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)的正反應為吸熱反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com