
【題目】能源可分為一級能源和二級能源,自然界中以現成形式提供的能源稱一級能源,需依靠其他能源的能量間接制取的能源稱為二級能源.據此判斷,下列敘述正確的是( )
A.天然氣是二級能源
B.石油是二級能源
C.電能是一級能源
D.水力是一級能源
科目:高中化學 來源: 題型:
【題目】二氧化氯(ClO2)為一種黃綠色氣體,是國際上公認的高效、廣譜、快速、安全的殺菌消毒劑,目前已開發出用電解法制取ClO2的新工藝.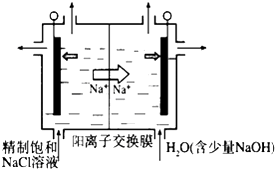
(1)①如圖示意用石墨做電極,在一定條件下電解飽和食鹽水制取ClO2。寫出陽極產生ClO2的電極反應式: .
②電解一段時間,當陰極產生的氣體體積為112mL(標準狀況)時,停止電解.通過陽離子交換膜的陽離子的物質的量為mol;用平衡移動原理解釋陰極區pH增大的原因。
(2)ClO2對污水中Fe2+、Mn2+、S2-和CN-等有明顯的去除效果.某工廠污水中含CN-amg/L,現用ClO2將CN-氧化,只生成兩種氣體,其離子反應方程式為;處理100m3這種污水,至少需要ClO2mol.
(3)為提高甲醇燃料的利用率,科學家發明了一種燃料電池,電池的一個電極通入空氣,另一個電極通入甲醇氣體,電解質是摻入了Y2O3的ZrO2晶體,在高溫下它能傳導O2-。電池工作時正極反應式為。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表為元素周期表的一部分,請按要求回答問題:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中元素______的非金屬性最強,元素_____的金屬性最強(填元素符號)。
(2)表中元素③的原子結構示意圖______;元素⑨形成的氫化物的電子式___________。
(3)表中元素④、⑨形成的氫化物的穩定性順序為_____> (填化學式)。
(4)表中元素⑧和⑨的最高價氧化物對應水化物的酸性強弱為_____> (填化學式)。
(5)表中元素③、④、⑥、⑦的原子半徑大小為____> > > (填元素符號)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一個容積為2L的密閉容器中,加入0.8molA2氣體和0.6molB2氣體,一定條件下發生如下反應:A2(g)+ B2(g) ![]() 2AB(g)ΔH<0,反應中各物質的濃度隨時間的變化情況如圖所示,下列說法不正確的是( )
2AB(g)ΔH<0,反應中各物質的濃度隨時間的變化情況如圖所示,下列說法不正確的是( )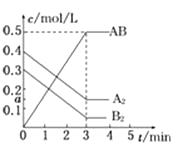
A.圖中a點的值為0.15
B.該反應的平衡常數K=0.03
C.溫度升高,平衡常數K值減小
D.平衡時A2的轉化率為62.5%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:
①CO(g)+![]() O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
②H2(g)+![]() O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
下列說法正確的是( )
A. 通常狀況下,氫氣的燃燒熱為241.8 kJ·mol-1
B. 由①可知,1 mol CO(g)和![]() mol O2(g)反應生成 1 mol CO2(g),放出283.0 kJ的熱量
mol O2(g)反應生成 1 mol CO2(g),放出283.0 kJ的熱量
C. 可用下圖表示2CO2(g)===2CO(g)+O2(g)反應過程中的能量變化關系
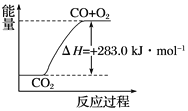
D. 分解1 mol H2O(g),其反應熱為-241.8 kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋅錳干電池是最早的實用電池。現用下列工藝回收正極材料中的金屬(部分條件未給出)。
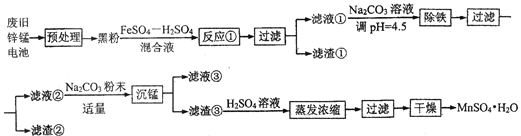
(1)堿性鋅錳電池反應為:Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH),電解質是KOH,該電池的負極材料為__________(填化學式),MnO(OH)中Mn的化合價為:________,正極反應式為:__________。
(2)黑粉的主要成份為 MnO2和石墨,寫出反應①的化學方程式:______。
(3)MnO2的轉化率與溫度的關系如下表:
溫度/℃ | 20 | 40 | 60 | 80 | 100 |
轉化率/℃ | 86.0 | 90.0 | 91.3 | 92.0 | 92.1 |
生產中常選反應溫度為80℃,其理由是:_______。
(4)“沉錳”過程中生成堿式碳酸錳[MnCO36Mn(OH)25H2O],寫出其離子反應方程式:_______,檢驗沉淀是否洗凈的操作是:_______。濾液③中可回收的物質為:________(填化學式)。
(5)“預處理”時,廢舊鋅錳電池經過拆解、篩分得到炭包,其中含 MnO2為34.8%。稱取5.000 g炭包,經處理得到3.211 g MnSO4H2O,計算錳的回收率為:_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上采用高溫活性炭催化CO與C12合成光氣(COCl2))。
(1)COCl2 中的原子最外層都達到 8電子穩定結構,光氣分子的電子式為_____。
(2)工業上利用天然氣(CH4)與CO2 進行高溫重整制備CO的反應為:CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH=+247.3 kJ/mol。已知:C—H、C≡O、H—H鍵的鍵能依次為413 kJ·mol-1、1076 kJ·mol-1、436 kJ·mol-1,則 C=O鍵的鍵能為____kJ·mol-1。
(3)光氣為窒息性毒劑,極易水解生成氯化氫,泄露后可用水霧吸收,化學方程式為:_______。
(4)某溫度下,在2L恒容密閉容器中充入 2 mol CO(g)、2 mol Cl2(g)和適量的活性炭,發生反應:Cl2(g)+CO(g)![]() COCl2(g) ΔH=-108 kJ·mol-1,測得在混合氣中COCl2的體積分數φ(COCl2)和時間t 的關系如圖曲線Ⅰ所示。
COCl2(g) ΔH=-108 kJ·mol-1,測得在混合氣中COCl2的體積分數φ(COCl2)和時間t 的關系如圖曲線Ⅰ所示。
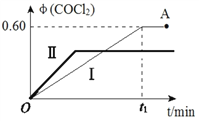
①下列情況不能表明該反應達到平衡狀態的是_______(填字母標號)。
A.CO的體積分數不改變
B.Cl2的消耗速率與COCl2的生成速率相等
C.體系中![]() 不改變
不改變
D.混合氣體的平均相對分子質量不再變化
②按曲線Ⅰ,平衡常數K=____。A點時,向容器中加入等物質的量CO和Cl2,再次達到平衡時,光氣的體積分數會 ______(填“增大”、 “減小”或“不變”。
③曲線Ⅱ相對曲線Ⅰ改變的條件可能是_______(填字母標號)。
A.恒容通入惰性氣體 B.通入 CO
C.增大壓強 D.升高溫度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:A、B、C、D四種短周期元素,A與D的原子序數之和等于B與C的原子序數之和,由D元素組成的單質在通常狀況下呈黃綠色,B、C、D三種元素位于同一周期,A、B、C三種元素的最高價氧化物對應的水化物分別為X、Y、Z,且存在如下圖轉化關系,試推斷回答下列問題。
(1)D元素原子的結構示意圖為;
(2)A、B、C三種元素的原子半徑由小到大的順序為(用元素符號表示);
(3)Y與C元素的最高價氧化物可以發生反應,該反應的離子方程式為;
(4)A的氣態氫化物的電子式 ;
(5)實驗室中,制取A的氣態氫化物的化學方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素a、b、c、d、e為前20號主族元素,原子序數依次增大。b元素原子最外層電子數與核外電子總數之比為2:3;c的氫化物能與其最高價氧化物對應的水化物反應生成一種鹽;a與b、c均可以形成電子總數為10的分子;d元素的氧化物能使品紅溶液褪色,且加熱后品紅顏色復原;e原子是前20號主族元素中原子半徑最大的。請回答:
(1)e元素在周期表中的位置_______________。
(2)bd2的電子式_______________;e2d的電子式_______________;ca3的空間構型_______________。
(3)e的最高價氧化物的水化物所含化學鍵類型為______________、_______________,晶體類型為_______________。其溶液與b的最高價氧化物反應的離子方程式為____________________________。
(4)在常溫常壓下,1g b的最簡單氣態氫化物完全燃燒放出的熱量約為56kJ,寫出該反應的熱化學方程式_____________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com