
【題目】以軟錳礦粉(主要含MnO2,還含有少量的Fe2O3、Al2O3等雜質)為原料制取高純MnO2的流程如下:
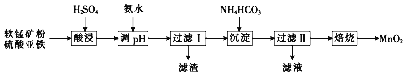
(1)酸浸時所發生主要反應的離子方程式為_____________。
(2)酸浸時加入一定體積的硫酸,硫酸濃度不能過小或過大。當硫酸濃度偏小時,酸浸時會有紅褐色渣出現,原因是_______。硫酸濃度不能過大的原因是_____________。
(3)過濾Ⅱ所得濾渣為MnCO3,濾液中溶質的主要成分是_____。
(4)焙燒MnCO3的裝置如下圖所示:
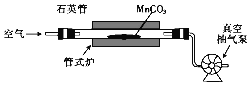
①焙燒時所發生反應的化學方程式為__________。
②焙燒一定時間后需轉動石英管,目的是_____。
【答案】 2Fe2++MnO2+4H+![]() 2Fe3++Mn2++2H2O 生成的Fe3+水解得到Fe(OH)3沉淀 用氨水沉淀雜質金屬離子時會消耗過多的氨水,造成原料的浪費 (NH4)2SO4 2MnCO3+O2
2Fe3++Mn2++2H2O 生成的Fe3+水解得到Fe(OH)3沉淀 用氨水沉淀雜質金屬離子時會消耗過多的氨水,造成原料的浪費 (NH4)2SO4 2MnCO3+O2![]() 2MnO2+2CO2 使得MnCO3能充分反應,提高MnCO3的轉化率
2MnO2+2CO2 使得MnCO3能充分反應,提高MnCO3的轉化率
【解析】軟錳礦粉(主要含MnO2,還含有少量的Fe2O3、Al2O3等雜質)酸浸時,Fe2O3、Al2O3被硫酸溶解生成硫酸鐵和硫酸鋁,二氧化錳與硫酸亞鐵在硫酸作用下發生氧化還原反應生成硫酸錳和硫酸鐵;加入氨水調節pH,使鋁離子和亞鐵離子沉淀除去,在濾液中加入碳酸氫銨,沉淀錳離子,然后在空氣中焙燒碳酸錳得到二氧化錳。
(1)酸浸時所發生主要反應是二氧化錳被硫酸亞鐵還原,反應的離子方程式為2Fe2++ MnO2+4H+=2Fe3++ Mn2++2H2O,故答案為:2Fe2++ MnO2+4H+=2Fe3++ Mn2++2H2O;
(2)酸浸時加入一定體積的硫酸,硫酸濃度不能過小或過大。當硫酸濃度偏小時,鐵離子水解程度較大,會有紅褐色氫氧化鐵沉淀出現;硫酸濃度過大,用氨水沉淀雜質金屬離子時會消耗過多的氨水,造成原料的浪費,故答案為:生成的Fe3+水解得到Fe(OH)3沉淀;用氨水沉淀雜質金屬離子時會消耗過多的氨水,造成原料的浪費;
(3)過濾II所得濾渣為MnCO3,濾液中主要含有(NH4)2SO4,故答案為:(NH4)2SO4;
(4)①在空氣中焙燒碳酸錳生成二氧化錳,反應的化學方程式為2MnCO3+O2![]() 2MnO2+2CO2,故答案為:2MnCO3+O2
2MnO2+2CO2,故答案為:2MnCO3+O2![]() 2MnO2+2CO2;
2MnO2+2CO2;
②焙燒一定時間后需轉動石英管,可以使得MnCO3能充分反應,提高MnCO3的轉化率,故答案為:使得MnCO3能充分反應,提高MnCO3的轉化率。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】以N2和H2為反應物,鹽酸酸化的NH4Cl溶液為電解質的原電池,工作原理如下圖所示,下列說法不正確的是
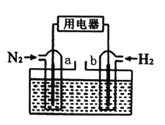
A. b電極為負極
B. 反應過程中,溶液中的Cl-向a電極移動
C. a電極的電極反應式為:N2+6e-+8H+=2NH4+
D. 電池反應為N2+3H2+2HCl=2NH4Cl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于下列事實的解釋正確的是
A. 在蔗糖中加入濃硫酸后出現發黑現象,說明濃硫酸具有吸水性
B. 濃硝酸在光照下顏色變黃,說明濃硝酸具有揮發性
C. 常溫下,濃硝酸可以用鋁罐貯存,說明鋁與濃硝酸不反應
D. 氨氣可以完成噴泉實驗,說明氨氣極易溶于水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】BaCl2溶液中通入SO2氣體,沒有沉淀生成。再通入或加入某物質后,有沉淀生成,則該物質不可能為
A. HCl B. NO2 C. NH3 D. FeC13
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在給定條件下,下列選項所示的物質間轉化均能實現的是
A. 飽和NaCl(aq) ![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
B. Al2O3![]() AlCl3(aq)
AlCl3(aq) ![]() 無水AlCl3
無水AlCl3
C. H2SO4(濃) ![]() SO2
SO2![]() (NH4)2SO3(aq)
(NH4)2SO3(aq)
D. Cl2(g) ![]() Ca(ClO)2
Ca(ClO)2![]() HClO
HClO
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知草酸H2C2O4是二元弱酸。室溫下向10 mL 0.01 mol·L-1 H2C2O4溶液中逐滴加入0.01 mol·L-1NaOH溶液,其pH變化曲線如圖所示(忽略溫度變化)。下列說法中錯誤的是( )
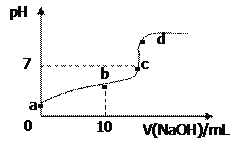
A. a點pH>2
B. b點表示的溶液中c(C2O42-)>c(H2C2O4)
C. c點時加入NaOH溶液的體積為20mL
D. d點存在c(Na+)+c(H+)=c(OH-)+2c(C2O42-)+c(HC2O4-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于堿金屬元素(M)的單質及其化合物說法不正確的是
A. 隨核電荷數遞增單質的熔點依次降低、硬度依次減小
B. 化合物中M的化合價均為+1價
C. 單質在空氣中都劇烈反應,生成M2O2
D. 隨核電荷數遞增單質與水反應的劇烈程度變強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某強酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32ˉ、SO32ˉ、SO42ˉ、C1ˉ中的若干種,現取X溶液進行連續實驗,實驗過程及產物如下:下列說法不正確的是( ) 
A.氣體A是NO
B.X中不能確定的離子是 A13+和C1ˉ
C.溶液E和氣體F能發生化學反應
D.X中肯定存在Fe2+、A13+、NH4+、SO42ˉ
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com