
T ℃、2 L密閉容器中某一反應在不同時刻的各物質的量如圖所示(E為固體,其余為氣體)。回答下列問題。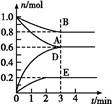
(1)寫出該反應的化學方程式: 。
(2)反應開始至3 min時,用D表示的平均反應速率為 mol·L-1·min-1。
(3)T ℃時,該反應的化學平衡常數K= 。
(4)第6 min時,保持溫度不變,將容器的體積縮小至原來的一半,重新達到平衡后,D的體積分數為 。
(5)另有一個2 L的密閉容器,T ℃、某一時刻,容器中各物質的物質的量如表所示。
| 物質 | A | B | D | E |
| 物質的量(mol) | 0.8 | 1.0 | 0.4 | 0.2 |
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:填空題
在一個體積為1 L的密閉容器中發生某化學反應:2A(g) B(g)+C(g),在三種不同條件下進行,其中實驗Ⅰ、Ⅱ都在800°C,實驗Ⅲ在850°C,B、C的起始濃度都為0,反應物A的濃度(mol·L-1)隨時間(min)的變化如圖所示。
B(g)+C(g),在三種不同條件下進行,其中實驗Ⅰ、Ⅱ都在800°C,實驗Ⅲ在850°C,B、C的起始濃度都為0,反應物A的濃度(mol·L-1)隨時間(min)的變化如圖所示。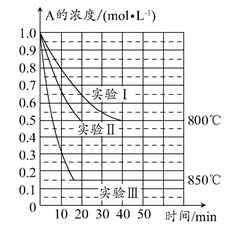
試回答下列問題:
(1)在實驗Ⅰ中,反應在20~40 min內A的平均反應速率為________mol·L-1·min-1。實驗Ⅱ和實驗Ⅰ相比,可能隱含的反應條件是________________。
(2)該反應的ΔH________0,其判斷理由是________。
(3)實驗Ⅰ第40 min末,若降低反應溫度,達到新的平衡后,A的濃度不可能為________(填序號)。
A.0.35 mol·L-1 B.0.4 mol·L-1 C.0.7 mol·L-1 D.0.8 mol·L-1
(4)若反應在800°C進行,在該1 L的密閉容器中加入1 mol A、0.2 mol He,達到平衡時A的轉化率應________。
A.等于86% B.等于50%
C.小于50% D.介于50%~86%之間
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
在一定溫度下,發生如下反應:N2(g)+3H2(g)  2NH3(g),起始時,充入的N2和H2的物質的量分別是3.0 mol和6.0 mol,平衡時生成NH3的物質的量是2.4 mol。已知容器的容積為5.0 L,試求:
2NH3(g),起始時,充入的N2和H2的物質的量分別是3.0 mol和6.0 mol,平衡時生成NH3的物質的量是2.4 mol。已知容器的容積為5.0 L,試求:
(1)H2的轉化率是________。
(2)平衡時混合氣體中N2的體積分數是________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
一定溫度下在體積為5 L的密閉容器中發生可逆反應。(Ⅰ)若某可逆反應的化學平衡常數表達式為:K=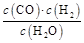
(1)寫出該反應的化學方程式:
(2)能判斷該反應一定達到化學平衡狀態的依據是 (填選項編號)。
| A.容器中氣體的平均相對分子質量不隨時間而變化 |
| B.v正(H2O)=v逆(H2) |
| C.容器中氣體的密度不隨時間而變化 |
| D.容器中總質量不隨時間而變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
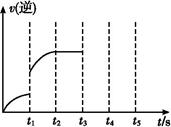
如圖表示某溫度時,反應N2O4(g) 2NO2(g)在前110 s內的反應進行情況,請根據圖像回答下列問題。
2NO2(g)在前110 s內的反應進行情況,請根據圖像回答下列問題。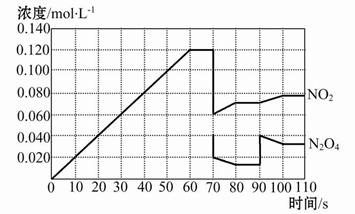
(1)該可逆反應達到平衡的時間段為 。
(2)反應進行到70 s時,改變的條件可能是 (填字母,下同),反應進行到90 s時,改變的條件可能是 。
| A.加入催化劑 | B.擴大容器體積 |
| C.升高溫度 | D.增大N2O4的濃度 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
一定溫度下,在一個10 L密閉容器中發生某可逆反應,其平衡常數表達式為K=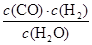 。請回答下列問題。
。請回答下列問題。
(1)該反應的化學方程式為__________________________________________;
若溫度升高,K增大,則該反應是________反應(填“吸熱”或“放熱”)。
(2)能判斷該反應一定達到平衡狀態的是________(填字母序號)。
| A.v正(H2O)=v逆(H2) |
| B.容器中氣體的平均相對分子質量不隨時間改變 |
| C.消耗n mol H2的同時消耗n mol CO |
| D.容器中物質的總物質的量不隨時間改變 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
常溫下,兩種溶液① 0.1 mol?L-1 NH3·H2O ② 0.1 mol?L-1 NH4Cl中:
(1)溶液①的pH 7(填“>”、“<”或“=”),其原因是: (用電離方程式表示)。
(2)溶液②呈 性(填“酸”、“堿”或“中”)。水解反應是吸熱反應,升溫可以 (填“促進”或“抑制”)NH4Cl的水解。
(3)下列關于兩種溶液中c(NH4+) 的敘述正確的是 (填字母)。
a.兩種溶液中c(NH4+) 都等于0.1 mol?L-1
b.兩種溶液中c(NH4+) 都小于0.1 mol?L-1
c.NH4Cl溶液中c(NH4+) 小于NH3·H2O溶液中c(NH4+)
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
2012年11月16日,5名男孩被發現死于貴州省畢節市七星關區街頭垃圾箱內,經當地公安部門初步調查,5名男孩是因在垃圾箱內生火取暖導致CO中毒而死亡。
(1)CO中毒是由于CO與血液中血紅蛋白的血紅素部分反應生成碳氧血紅蛋白,反應的化學方程式可表示為CO+HbO2 O2+HbCO,實驗表明,c(HbCO)即使只有c(HbO2)的
O2+HbCO,實驗表明,c(HbCO)即使只有c(HbO2)的 ,也可造成人的智力損傷。已知t ℃時上述反應的平衡常數K=200,吸入肺部O2的濃度約為1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的
,也可造成人的智力損傷。已知t ℃時上述反應的平衡常數K=200,吸入肺部O2的濃度約為1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的 ,則吸入肺部CO的濃度不能超過________mol·L-1。
,則吸入肺部CO的濃度不能超過________mol·L-1。
(2)有如下三個與CO相關的反應:
Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=Q1,平衡常數K1
FeO(s)+CO(g) ΔH=Q1,平衡常數K1
Fe(s)+H2O(g) FeO(s)+H2(g) ΔH=Q2,平衡常數為K2
FeO(s)+H2(g) ΔH=Q2,平衡常數為K2
H2(g)+CO2(g) CO(g)+H2O(g) ΔH=Q3,平衡常數為K3
CO(g)+H2O(g) ΔH=Q3,平衡常數為K3
在不同的溫度下K1、K2、K3的數值如下:
| T/℃ | K1 | K2 | K3 |
| 700 | 1.47 | 2.38 | 0.62 |
| 900 | 2.15 | 1.67 | |
 CO(g)+H2O(g)已經建立的平衡逆向移動,可采取的措施有________。
CO(g)+H2O(g)已經建立的平衡逆向移動,可采取的措施有________。查看答案和解析>>
科目:高中化學 來源: 題型:填空題
化學反應原理在科研和生產中有廣泛應用。
(1)利用“化學蒸氣轉移法”制備TaS2晶體,發生如下反應:
TaS2(s)+2I2(g) TaI4(g)+S2(g) (Ⅰ)
TaI4(g)+S2(g) (Ⅰ)
某溫度反應(Ⅰ)的K=4,向某恒容密閉容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡轉化率為 。
(2)如下圖所示,反應(Ⅰ)在石英真空管中進行,先在溫度高(T2)的一端放入未提純的TaS2粉末和少量I2(g),加熱一段時間后,在另一端溫度低(T1)的一端得到了純凈的TaS2晶體,則該正反應的△H 0(填“>”或“<”),上述反應體系中循環使用的物質是 。
(3)上圖為鈉硫高能電池的結構示意圖。該電池的工作溫度為320℃左右,電池反應為2Na + xS=Na2Sx,正極的電極反應式為____________________________。M(由Na2O和Al2O3制得)的兩個作用是________________________________________________和隔離鈉與硫。
(4)寫出Na2S溶液水解的離子方程式_______________________________________,Na2S溶液中c(H+)+ c(Na+)=________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com