
【題目】消除尾氣中的NO是環境科學研究的熱點課題。
I.NO氧化機理
已知:2NO(g)+O2(g)![]() 2NO2(g) ΔH=-110kJmol-1
2NO2(g) ΔH=-110kJmol-1
T1℃時,將NO和O2按物質的量之比為2:1充入剛性反應容器中(忽略NO2與N2O4的轉化)。
(1)下列可以作為反應已經到達平衡狀態的判斷依據的是____。
A.2v正(O2)=v逆(NO2)
B.NO與O2的物質的量之比為2:1
C.容器內混合氣體的密度保持不變
D.K不變
E.容器內混合氣體的顏色保持不變
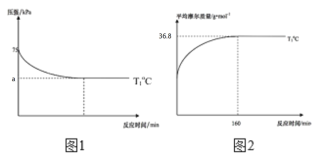
(2)通過現代科學技術動態跟蹤反應的進行情況,得到容器內混合氣體的壓強、平均摩爾質量隨反應時間的變化曲線如圖1圖2所示。則反應2NO(g)+O2(g)![]() 2NO2(g)在T1℃時的平衡常數Kp=____。[對于氣相反應,用某組分B的平衡壓強p(B)代替物質的量濃度c(B)也可表示平衡常數,記作Kp,如p(B)=px(B),p為平衡總壓強,x(B)為平衡系統中B的物質的量分數]。保持其它條件不變,僅改變反應溫度為T2℃(T2>T1),在圖2中畫出容器內混合氣體的平均摩爾質量隨反應時間的變化趨勢圖_____。
2NO2(g)在T1℃時的平衡常數Kp=____。[對于氣相反應,用某組分B的平衡壓強p(B)代替物質的量濃度c(B)也可表示平衡常數,記作Kp,如p(B)=px(B),p為平衡總壓強,x(B)為平衡系統中B的物質的量分數]。保持其它條件不變,僅改變反應溫度為T2℃(T2>T1),在圖2中畫出容器內混合氣體的平均摩爾質量隨反應時間的變化趨勢圖_____。
II.NO的工業處理
(3)H2還原法:2NO(g)+2H2(g)![]() N2(g)+2H2O(g) ΔH1
N2(g)+2H2O(g) ΔH1
已知在標準狀況下,由元素最穩定的單質生成1mol純化合物時的焓變叫做標準摩爾生成焓。NO(g)和H2O(g)的標準摩爾生成焓分別為+90kJmol-1、-280kJmol-1。則ΔH1=____。
(4)O3-CaSO3聯合處理法
NO可以先經O3氧化,再用CaSO3水懸浮液吸收生成的NO2,轉化為HNO2。已知難溶物在溶液中并非絕對不溶,同樣存在著一定程度的沉淀溶解平衡。在CaSO3水懸浮液中加入Na2SO4溶液能提高SO32-對NO2的吸收速率,請用平衡移動原理解釋其主要原因____。
(5)電化學處理法
工業上以多孔石墨為惰性電極,稀硝酸銨溶液為電解質溶液,將NO分別通入陰陽兩極,通過電解可以得到濃的硝酸銨溶液。則電解時陽極發生的電極反應為____。
【答案】AE 0.08 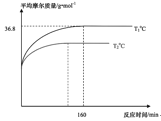 -740kJmol-1 對于反應CaSO3(s)
-740kJmol-1 對于反應CaSO3(s)![]() Ca2+(aq)+SO32-(aq),加入Na2SO4溶液時,SO42-結合部分Ca2+,使其平衡向正反應方向移動,c(SO32-)增大,吸收NO2的速率增大 NO-3e-+2H2O=NO3-+4H+
Ca2+(aq)+SO32-(aq),加入Na2SO4溶液時,SO42-結合部分Ca2+,使其平衡向正反應方向移動,c(SO32-)增大,吸收NO2的速率增大 NO-3e-+2H2O=NO3-+4H+
【解析】
I.(1)在一定條件下,當一個可逆反應的正反應速率與逆反應速率相等時,反應物的濃度與生成物的濃度不再改變,達到一種表面靜止的狀態,即“化學平衡狀態”。其中,正反應速率與逆反應速率相等是化學平衡狀態的實質,而反應物的濃度與生成物的濃度不再改變是化學平衡狀態的表現。
A.當2v正(O2)=v逆(NO2)時,說明反應已達平衡態,故A正確;
B. NO與O2的物質的量之比為2:1時,不能說明該反應反應物的濃度與生成物的濃度不再改變,故B錯誤;
C.根據質量守恒定律,容器內氣體的質量恒定不變,則恒容容器內混合氣體的密度始終保持不變,不能說明達到化學平衡狀態,故C錯誤;
D.該反應中平衡常數K只與溫度有關,則不能用K不變來判斷化學平衡狀態,故D錯誤;
E.容器內混合氣體的顏色保持不變,則說明反應物的濃度與生成物的濃度不再改變,即達到化學平衡狀態,故E正確;
綜上所述,答案為AE;
(2)設容器內二氧化氮與氧氣分別為2mol、1mol,達平衡態時,氧氣轉化了xmol,則可列三段式為:
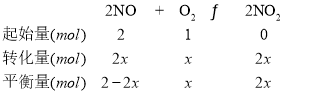
平衡時平均摩爾質量為36.8g/mol,則有![]() ,解得x=0.5,則NO、O2、NO2的物質的量分數分別為0.4、0.2、0.4,同溫同體積,根據壓強之比等于物質的量之比,有
,解得x=0.5,則NO、O2、NO2的物質的量分數分別為0.4、0.2、0.4,同溫同體積,根據壓強之比等于物質的量之比,有![]() ,代入x,解得a=62.5,根據平衡常數公式有
,代入x,解得a=62.5,根據平衡常數公式有![]() ;因為該反應為放熱反應,升高溫度時,反應速率會加快,平衡逆向移動,平均摩爾質量會減小,容器內混合氣體的平均摩爾質量隨反應時間的變化趨勢圖為
;因為該反應為放熱反應,升高溫度時,反應速率會加快,平衡逆向移動,平均摩爾質量會減小,容器內混合氣體的平均摩爾質量隨反應時間的變化趨勢圖為 ,故答案為:0.08;
,故答案為:0.08; ;
;
(3)![]() =生成物標準摩爾生成焓之和-反應物標準摩爾生成焓之和=-280kJmol-1×2-90kJmol-1×2=-740kJmol-1,故答案為:-740kJmol-1;
=生成物標準摩爾生成焓之和-反應物標準摩爾生成焓之和=-280kJmol-1×2-90kJmol-1×2=-740kJmol-1,故答案為:-740kJmol-1;
(4)相同條件下,硫酸鈣的溶解度小于亞硫酸鈣的溶解度,亞硫酸鈣可轉化為硫酸鈣,對于反應CaSO3(s)![]() Ca2+(aq)+SO32-(aq),加入Na2SO4溶液時,SO42-結合部分Ca2+,使其平衡向正反應方向移動,c(SO32-)增大,吸收NO2的速率增大,故答案為:對于反應CaSO3(s)
Ca2+(aq)+SO32-(aq),加入Na2SO4溶液時,SO42-結合部分Ca2+,使其平衡向正反應方向移動,c(SO32-)增大,吸收NO2的速率增大,故答案為:對于反應CaSO3(s)![]() Ca2+(aq)+SO32-(aq),加入Na2SO4溶液時,SO42-結合部分Ca2+,使其平衡向正反應方向移動,c(SO32-)增大,吸收NO2的速率增大;
Ca2+(aq)+SO32-(aq),加入Na2SO4溶液時,SO42-結合部分Ca2+,使其平衡向正反應方向移動,c(SO32-)增大,吸收NO2的速率增大;
(5)由電解原理可知,陽極發生氧化反應,則一氧化氮轉化為硝酸根,其電極方程式為NO-3e-+2H2O=NO3-+4H+,故答案為:NO-3e-+2H2O=NO3-+4H+。


 黎明文化寒假作業系列答案
黎明文化寒假作業系列答案 寒假天地重慶出版社系列答案
寒假天地重慶出版社系列答案科目:高中化學 來源: 題型:
【題目】下列變化①碘的升華②燒堿熔化③氯化鈉溶于水④氯化氫溶于水⑤氧氣溶于水⑥氯化銨受熱分解。
氯化銨的電子式是______________;未發生化學鍵破壞的是______________(填序號,下同);僅發生離子鍵破壞的是______________;僅發生共價鍵破壞的是______________;既發生離子鍵又發生共價鍵破壞的是______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2005年法拉利公司發布的敞篷車(法拉利Superamerica),其玻璃車頂采用了先進的電致變色技術,即在原來玻璃材料基礎上增加了有電致變色系統組成的五層膜材料(如圖所示)。其工作原理是:在外接電源(外加電場)下,通過在膜材料內部發生氧化還原反應,實現對器件的光透過率進行多級可逆性調節。下列有關說法中不正確的是( )
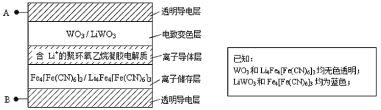
A.當A外接電源正極時,Li+脫離離子儲存層
B.當A外接電源負極時,電致變色層發生反應為:WO3+Li++e-=LiWO3
C.當B外接電源正極時,膜的透過率降低,可以有效阻擋陽光
D.該電致變色系統在較長時間的使用過程中,離子導體層中Li+的量可保持基本不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】學校化學研究小組對實驗室某廢液缸里的溶液進行檢測分析,提出假設:該溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、I-、SO42-等離子中的幾種離子。實驗探究:
①取少量該溶液滴加紫色石蕊試液,溶液變紅。
②取100mL該溶液于試管中,滴加足量Ba(NO3)2溶液,加稀硝酸酸化后過濾得到0.3mol白色沉淀甲,向濾液中加入AgNO3溶液未見沉淀產生。
③另取100mL該溶液,逐漸加入Na2O2粉末,產生的沉淀和氣體與所加Na2O2粉末物質的量的關系曲線如圖所示。下列說法中不正確的是( )
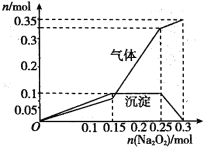
A.該溶液中一定不含有I-、HCO3-、Cl-
B.該溶液中一定含有K+,其物質的量濃度為1molL-1
C.在溶液中加入0.25~0.3molNa2O2時,發生反應的化學方程式為2Na2O2+2H2O=4NaOH+O2↑、Al(OH)3+NaOH=NaAlO2+2H2O
D.該溶液能使紫色石蕊試液變紅的唯一原因是NH4+發生水解
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物甲由四種元素組成。某化學研究小組按如圖流程探究其組成:

已知丙和丁是相對分子質量相同的常見氣體,其中丁是空氣的主要成分之一。請回答下列問題:
(1)甲的化學式為____。
(2)甲發生爆炸反應的化學方程式為____。
(3)已知化合物甲中,有兩種元素的化合價為最高正價,另兩種元素的化合價為最低負價,則爆炸反應中被氧化的元素與還原產物的物質的量之比為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學原理正確的是( )
A. 沸點:HF>HCl>HBr>HI
B. 一定條件下![]() 可以自發進行,則
可以自發進行,則![]()
C. 常溫下,![]() 溶液加水,水電離的
溶液加水,水電離的![]() 保持不變
保持不變
D. 標況下,1mol![]() 分別與足量Na和
分別與足量Na和![]() 反應,生成氣體的體積比為
反應,生成氣體的體積比為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫化物是一類重要的化工原料,具有廣泛的用途。完成下列填空:
(1)Na2S溶液中,水的電離程度會_________(填“增大”、 “減小”或“不變”);微熱該溶液, pH 會_________(填“增大”、 “減小”或“不變”)。
(2)Na2S 溶液中各離子濃度由大到小的順序為: ___________________________________。
(3)向 Na2S 和 Na2SO3 的混合溶液中加入足量的稀硫酸溶液,發生以下反應:
__ Na2S+ __ Na2SO3+__ H2SO4→__ Na2SO4+__ S↓+ __ H2O
①配平上述化學方程式,標出電子轉移的方向和數目______。
②反應中被氧化的元素是______________。
(4)CuS和FeS都是難溶于水的固體,工業上可用 FeS 將廢水中的 Cu2+轉化為CuS除去,請結合相關原理進行解釋:_________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液中可能含有如下離子:H+、Mg2+、Al3+、NH![]() 、Cl-、AlO
、Cl-、AlO![]() 。當向該溶液中逐滴加入NaOH溶液時,產生沉淀的物質的量(n)與加入NaOH溶液的體積(V)的關系如圖所示,下列說法正確的是
。當向該溶液中逐滴加入NaOH溶液時,產生沉淀的物質的量(n)與加入NaOH溶液的體積(V)的關系如圖所示,下列說法正確的是
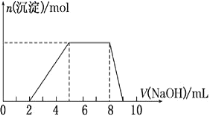
A.原溶液中一定含有的陽離子是H+、Mg2+、Al3+、NH![]()
B.反應最后形成的溶液中的溶質含AlCl3
C.原溶液中Al3+與NH![]() 的物質的量之比為1∶3
的物質的量之比為1∶3
D.原溶液中含有的陰離子是Cl-、AlO![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素周期表與元素周期律在學習、研究中有很重要的作用。下表是元素周期表中5種元素的相關信息,其中Q、W、X位于同一周期。
元素 | 信息 |
Q | 地殼中含量第2的元素 |
W | 最高正化合價為+7價 |
X | 最高價氧化物對應的水化物在本周期中堿性最強 |
Y | 焰色反應為紫色 |
Z | 原子結構示意圖為 |
(1)Q在元素周期表中的位置是___________。
(2)Q、W的最高價氧化物對應的水化物中,酸性較強的物質是___________。(填化學式)
(3)金屬性Y強于X,用原子結構解釋原因:___________,失電子能力Y大于X。(用元素符號回答問題)
(4)下列對于Z及其化合物的推斷中,正確的是___________(填序號)。
①Z的最低負化合價與W的最低負化合價相同
②Z的氫化物的穩定性弱于W的氫化物的穩定性
③Z的單質可與X和W形成的化合物的水溶液發生置換反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com