
【題目】人類活動產生的CO2長期積累,威脅到生態環境,其減排問題受到全世界關注。
(1)工業上常用高濃度的K2CO3 溶液吸收CO2,得溶液X,再利用電解法使K2CO3 溶液再生,其裝置示意圖如下:

①在陽極區發生的反應包括 和H++HCO3-![]() H2O+CO2↑。
H2O+CO2↑。
②簡述CO32-在陰極區再生的原理 。
(2)再生裝置中產生的CO2和H2在一定條件下反應生成甲醇等產物,工業上利用該反應合成甲醇。已知:25 ℃,101 KPa下:
H2(g)+![]() O2(g)
O2(g)![]() H2O(g)ΔH1=-242kJ·mol-1
H2O(g)ΔH1=-242kJ·mol-1
CH3OH(g)+![]() O2(g)
O2(g)![]() CO2(g)+2H2O(g)ΔH2=-676kJ·mol-1
CO2(g)+2H2O(g)ΔH2=-676kJ·mol-1
①寫出CO2和H2生成氣態甲醇等產物的熱化學方程式 。
②下面表示合成甲醇的反應的能量變化示意圖,其中正確的是 (填字母序號)。

A B C D
(3)微生物燃料電池是一種利用微生物將化學能直接轉化成電能的裝置。已知某種甲醇微生物燃料電池中,電解質溶液為酸性,示意圖如下:
 、
、
①該電池外電路電子的流動方向為 (填寫“從A到B”或“從B到A”)。
②A電極附近甲醇發生的電極反應式為 。
【答案】
(1)①4OH–-4e-=2H2O+O2↑;②HCO3–存在電離平衡:HCO3–![]() H++CO32-,陰極H+放電濃度減小平衡右移。(或陰極H+放電OH-濃度增大,OH-與HCO3–反應生成CO32-)
H++CO32-,陰極H+放電濃度減小平衡右移。(或陰極H+放電OH-濃度增大,OH-與HCO3–反應生成CO32-)
(2)①CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-50kJ·mol-1;②A
(3)①從A到B;②CH3OH+H2O-6e-=6H++CO2↑
【解析】
試題分析:(1)①陽極上氫氧根離子放電生成氧氣和水,電極反應式為4OH--4e-═2H2O+O2↑,故答案為:4OH--4e-═2H2O+O2↑;②HCO3-存在電離平衡:HCO3-H++CO32-,陰極H+放電濃度減小平衡右移,CO32-再生;陰極H+放電OH-濃度增大,OH-與HCO3-反應生成CO32-,CO32-再生,故答案為:HCO3-存在電離平衡:HCO3-![]() H++CO32-,陰極H+放電濃度減小,平衡右移,CO32-再生;陰極H+放電OH-濃度增大,OH-與HCO3-反應生成CO32-,CO32-再生;
H++CO32-,陰極H+放電濃度減小,平衡右移,CO32-再生;陰極H+放電OH-濃度增大,OH-與HCO3-反應生成CO32-,CO32-再生;
(2)①H2(g)+![]() O2(g)═H2O(g)△H1=-242kJ/mol①,CH3OH(g)+
O2(g)═H2O(g)△H1=-242kJ/mol①,CH3OH(g)+![]() O2(g)═CO2(g)+2H2O(g) △H2=-676kJ/mol ②,將方程式3①-②得CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H =3×(-242kJ/mol)-(-676kJ/mol) =-50 kJ/mol,故答案為:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol;②該反應是放熱反應,反應物總能量大于生成物總能量,物質越穩定,其能量越小,所以液態物質的能量小于氣態物質,則符合條件的圖象是A,故選A;
O2(g)═CO2(g)+2H2O(g) △H2=-676kJ/mol ②,將方程式3①-②得CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H =3×(-242kJ/mol)-(-676kJ/mol) =-50 kJ/mol,故答案為:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol;②該反應是放熱反應,反應物總能量大于生成物總能量,物質越穩定,其能量越小,所以液態物質的能量小于氣態物質,則符合條件的圖象是A,故選A;
(3)①該燃料電池中,甲醇失電子發生氧化反應,所以A是負極,B是正極,電子從負極A流向正極B,故答案為:從A到B;②A電極上甲醇失電子和水反應生成氫離子和二氧化碳,電極反應式為:CH3OH+H2O-6e-═6H++CO2↑,故答案為:CH3OH+H2O-6e-═6H++CO2↑。


科目:高中化學 來源: 題型:
【題目】綠礬可用作除草劑、凈水劑或抗貧血藥等.某研究小組同學采用硫鐵礦焙燒后的燒渣(主要成份為Fe2O3、Al2O3和SiO2,不考慮其他雜質)制備綠礬,設計了如下流程.

請回答:
(1)①~③所涉及的實驗操作方法中,用到過濾的是 (填序號).
(2)③中發生反應的離子方程式是 .
(3)下列說法正確的是(填字母) .
a.①中可選用鹽酸,③中只能用硫酸
b.溶液B中含有OH﹣、SiO32﹣、AlO2﹣等陰離子
c.④中發生了氧化還原反應,固體C做還原劑
(4)原燒渣中Fe2O3的質量分數為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:2SO2(g)+O2(g)![]() 2SO3(g) △H=-196 kJ/mol。某溫度下,向一體積為2L的密閉容器中充入0.2molSO2和0.1molO2,5min后達到平衡,共放出熱量11.76kJ,下列說法正確的是
2SO3(g) △H=-196 kJ/mol。某溫度下,向一體積為2L的密閉容器中充入0.2molSO2和0.1molO2,5min后達到平衡,共放出熱量11.76kJ,下列說法正確的是
A.5min內用O2表示的反應速率為0.12mol/(L·min)
B.加入催化劑,可使該反應的化學反應速率加快,△H變小
C.SO2的平衡濃度為0.12mol/L
D.達到平衡時,若增大容器的體積,則該反應的化學反應速率減慢
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】人體內有20多種微量元素,它們的質量總和不到體重的千萬分之一,但是對人的健康卻起著重要的作用,下列各組元素全部是微量元素的是( )
A. Na K Cl S O B. B Mn Fe Zn Cu
C. N Mg Mo P Zn D. Mo Ca Cu Mg C
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于N2、N2O、N2O5的敘述,正確的是( )
A. 每個分子中都含有氮分子 B. 每個分子中的氮原子個數相等
C. 每種物質中氮元素的質量分數相同 D. 都屬于氧化物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗的反應原理用離子方程式表示正確的是( )
A.室溫下,測的氯化銨溶液pH<7,證明一水合氨的是弱堿:NH4++2H2O=NH3·H2O+H3O+
B.用氫氧化鈉溶液除去鎂粉中的雜質鋁:2Al+2OH-+2H2O=2AlO2-+3H2↑
C.用碳酸氫鈉溶液檢驗水楊酸中的羧基: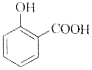 +2HCO3-→
+2HCO3-→ +2H2O+2CO2↑
+2H2O+2CO2↑
D.用高錳酸鉀標準溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下列實驗裝置進行相應實驗,能達到實驗目的是( )

A.用圖(a)所示裝置除去Cl2中含有的少量HCl
B.用圖(b)所示裝置蒸干NH4Cl飽和溶液制備NH4Cl晶體
C.用圖(c)所示裝置制取少量純凈的CO2氣體
D.用圖(d)所示裝置分離CCl4萃取碘水后已分層的有機層和水層
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA為阿伏加德羅常數的值,下列敘述正確的是
A.NA個CO2分子占有的體積一定為22.4L
B.標準狀況下,22.4L四氯化碳含有的分子數為NA
C.常溫常壓下,1.06g Na2CO3含有的Na+數為0.02 NA
D.物質的量濃度為0.5mol/L的MgCl2溶液中,含Cl-個數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值.下列敘述正確的是( )
A.9g甲基(﹣CH3)所含有的電子數是10 NA個
B.22.4L乙烷中含有的共價鍵數為7NA個
C.常溫下,14g乙烯和丙烯的混合物中總原子數為3NA
D.4.2g C3H6中含有的碳碳雙鍵數一定為0.1NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com