
【題目】氮及其化合物在工農業生產中具有重要作用。
(1)某小組進行工業合成氨N2(g)+3H2(g)2NH3(g)+Q的模擬研究,在1L密閉容器中,分別加入0.1molN2和0.3molH2。實驗①、②、③中c(N2)隨時間(t)的變化如圖所示,實驗②從開始到達平衡狀態的過程中,用H2表示的平均反應速率為____。與實驗①相比,實驗②所采用的實驗條件可能為____(填字母)
a.增大壓強 b.減小壓強 c.升高溫度 d.降低溫度 e.使用催化劑

(2)NH3用于處理廢氣中的氮氧化物,其反應原理為2NH3(g)+NO(g)+NO2(g)2N2(g)+3H2O(g)+Q,欲提高廢氣中氮氧化物的轉化率,可采取的措施是____(填字母);
a.升高溫度 b.增大壓強 c.增大NH3的濃度
【答案】0.012molL-1min-1 e c
【解析】
(1)根據v=![]() 計算反應速率,根據圖象可知②到達平衡的時間比①短,到達平衡時N2的濃度與①相同,化學平衡不移動,故②與①相比加了催化劑,①和③比較可知,③的速率比①小,平衡時氮氣的濃度高,即平衡逆向移動,故③減小了壓強;
計算反應速率,根據圖象可知②到達平衡的時間比①短,到達平衡時N2的濃度與①相同,化學平衡不移動,故②與①相比加了催化劑,①和③比較可知,③的速率比①小,平衡時氮氣的濃度高,即平衡逆向移動,故③減小了壓強;
(2)提高廢氣中氮氧化物的轉化率,應改變條件使平衡向正反應移動,結合平衡移動原理分析。
(1)根據圖象可知,②在10min時達到平衡,此時氮氣的濃度變化為0.04mol/L,根據方程式可知,氨氣的濃度變化了0.08mol/L,根據v=![]() 可知v(NH3)=
可知v(NH3)=![]() =0.008molL-1min-1,則v(H2)=0.012molL-1min-1,根據圖象可知②到達平衡的時間比①短,到達平衡時N2的濃度與①相同,化學平衡不移動,故②與①相比加了催化劑,故答案為e;
=0.008molL-1min-1,則v(H2)=0.012molL-1min-1,根據圖象可知②到達平衡的時間比①短,到達平衡時N2的濃度與①相同,化學平衡不移動,故②與①相比加了催化劑,故答案為e;
(2)提高廢氣中氮氧化物的轉化率,應改變條件使平衡向正反應移動;
a.該反應正反應是放熱反應,升高溫度,平衡向逆反應移動,氮氧化物的轉化率降低,故a錯誤;
b.該反應正反應是體積增大的反應,增大壓強,平衡向逆反應移動,氮氧化物的轉化率降低,故b錯誤;
c.增大NH3的濃度,平衡向正反應移動,氮氧化物的轉化率增大,故c正確;
故答案為c。


 期末1卷素質教育評估卷系列答案
期末1卷素質教育評估卷系列答案科目:高中化學 來源: 題型:
【題目】如表是幾種常見弱酸的電離平衡常數(25℃)。
酸 | 電離方程式 | 電離平衡常數K |
CH3COOH | CH3COOH | 1.76×10-5 |
H2CO3 | H2CO3 | K1=4.4×10-7 |
HCO | K2=4.7×10-11 | |
H2S | H2S | K1=1.3×10-7 |
HS- | K2=7.1×10-15 | |
H3PO4 | H3PO4 | K1=7.1×10-3 |
H2PO4- | K2=6.3×10-8 | |
HPO42- | K3=4.2×10-13 |
(1) 當溫度升高時,K值_____(填“增大”“減小”或“不變”)。
(2) 若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看成酸,其中酸性最強的是_____,最弱的是_____。由離子反應規律及上述數據判斷,下列各組物質在溶液中混合后能發生反應的有_____(填字母)。
a. CH3COOH+NaH2PO4
b. H2S+Na2CO3
c. CO2+Na2HPO4
(3) 分析多元弱酸各步電離的K值大小,你認為一定濃度的某多元弱酸溶液中,c(H+)的大小主要由_______決定。假設某氫硫酸溶液的濃度為0.001 3 mol·L-1,則溶液中c(H+)=______。
(4) 請設計一種方案,能通過直觀的實驗現象判斷醋酸的酸性強于碳酸,該方案所用試劑是____,反應的化學方程式為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏加德羅常數的值,下列說法錯誤的是
A.標準狀況下,22.4 L環丙烷和丙烯的混合氣體中所含共用電子對數為9NA
B.56g鐵在足量氧氣中完全燃燒,轉移的電子數小于3NA
C.16g O2和14C2H4的混合物中所含中子數為8NA
D.常溫下,1 L 0.5 mol/L CH3COONH4溶液的pH=7,則溶液中CH3COO-與NH4+的數目均為0.5NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學——選修5:有機化學基礎]環丙貝特(H)是一種降血脂藥物,可明顯降低極低密度和低密度脂蛋白水平,并升高高密度脂蛋白,通過改善膽固醇的分布,可減少CH和LDL在血管壁的沉積,還有溶解纖維蛋白和阻止血小板凝聚作用。如圖是合成環丙貝特的一種新方法:
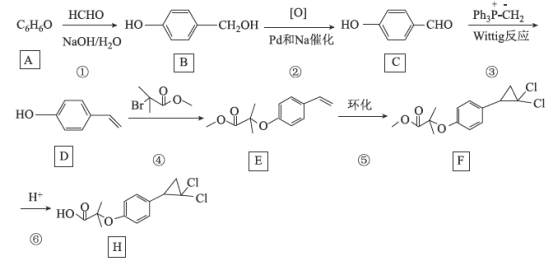
回答下列問題:
(1)C的化學名稱為______________________
(2)F中含氧官能團的名稱為______________
(3)H的分子式為________________________
(4)反應①的反應類型為___________,反應④的化學方程式為______________________
(5)M為![]() 的同分異構體,能與NaHCO3溶液反應產生氣體,則M的結構共有種____(不考慮立體異構);其中1HNMR中有3組峰,且峰面積之比為6:2:1的結構簡式為_______
的同分異構體,能與NaHCO3溶液反應產生氣體,則M的結構共有種____(不考慮立體異構);其中1HNMR中有3組峰,且峰面積之比為6:2:1的結構簡式為_______
(6)利用Wittig反應,設計以環己烷為原料(其他試劑任選),制備![]() 的合成路線:______________________。
的合成路線:______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列曲線分別表示元素的某種性質與核電荷數的關系(Z為核電荷數,Y為元素的有關性質)。
(1)把與下面元素有關性質相符的曲線標號填入相應的空格中:
a.  b.
b.  c.
c.  d.
d. 
①第ⅡA族元素的價電子數________。
②第三周期元素的最高化合價________。
③F-、Na+、Mg2+、Al3+的離子半徑________。
(2)元素X、Y、Z、M、N均為短周期主族元素,且原子序數依次增大。已知Y原子最外層電子數與核外電子總數之比為3∶4;M元素原子的最外層電子數與電子層數之比為4∶3;N-、Z+、X+的半徑逐漸減小;化合物XN常溫下為氣體。據此回答:
①X為___________(名稱),Y為____________(元素符號),Z原子結構示意圖為________________。
②N的最高價氧化物的水化物的化學式為________________。
③M的最高價氧化物的化學式為________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知常溫下![]() 的電離平衡常數
的電離平衡常數![]() ,
,![]() 的電離平衡常數
的電離平衡常數![]() ,
,![]() 的電離平衡常數
的電離平衡常數![]() 。若溶液混合引起的體積變化可忽略,則室溫時下列指定溶液中微粒物質的量濃度關系正確的是( )
。若溶液混合引起的體積變化可忽略,則室溫時下列指定溶液中微粒物質的量濃度關系正確的是( )
A.![]() 溶液:
溶液:![]()
B.![]() 的
的![]() 溶液和
溶液和![]() 的
的![]() 溶液等體積混合:
溶液等體積混合:![]()
C.![]() 的
的![]() 和
和![]() 的
的![]() 溶液等體積混合:
溶液等體積混合:![]()
D.![]() 氨水和
氨水和![]() 溶液等體積混合:
溶液等體積混合:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酸鈉(NaNO2)在纖維紡織品的染色和漂白、照相、生產橡膠、制藥等領域有廣泛應用,也常用于魚類、肉類等食品的染色和防腐。但因其有毒,所以在食品行業中的用量有嚴格限制。現用下圖所示儀器(夾持裝置已省略)及藥品,探究亞硝酸鈉與硫酸反應及氣體產物的成分。
已知:①NO+NO2+2OH-===2NO2-+H2O;
②氣體液化的溫度:NO2為21 ℃,NO為-152 ℃。
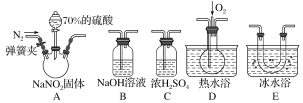
(1)為了檢驗裝置A中生成的氣體產物,儀器的連接順序(按左→右連接)為A、C、________、________、________。
(2)反應前應打開彈簧夾,先通入一段時間氮氣,排除裝置中的空氣,目的是________________________________________________________________________。
(3)在關閉彈簧夾、打開分液漏斗活塞、滴入70%硫酸后,A中產生紅棕色氣體。
①確認A中產生的氣體含有NO,依據的現象是________________________。
②裝置E的作用是_________________________________________________。
(4)如果向D中通入過量O2,則裝置B中發生反應的化學方程式為___________。
(5)通過上述實驗探究過程,可得出裝置A中反應的化學方程式是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,向容積為2 L的密閉容器中通入兩種氣體,發生化學反應生成另外兩種氣體,反應中各物質的物質的量變化如圖所示,對該反應的推斷合理的是
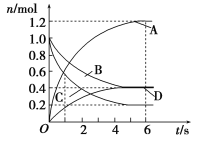
A. 該反應的化學方程式為3B(g)+4D(g)![]() 6A(g)+2C(g)
6A(g)+2C(g)
B. 反應進行到1 s時,v(A)=v(D)
C. 反應進行到6 s時,B的平均反應速率為0.05 mol/(L·s)
D. 反應進行到6 s時,各物質的反應速率相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在甲、乙、丙三個不同密閉容器中按不同方式投料,一定條件下發生反應(起始溫度和起始體積相同):A2(g)+3B2(g)![]() 2AB3(g) ΔH<0,相關數據如下表所示:
2AB3(g) ΔH<0,相關數據如下表所示:
容器 | 甲 | 乙 | 丙 |
相關條件 | 恒溫恒容 | 絕熱恒容 | 恒溫恒壓 |
反應物投料 | 1mol A2、3molB2 | 2molAB3 | 2mol AB3 |
反應物的轉化率 | a甲 | a乙 | a丙 |
反應的平衡常數K= | K甲 | K乙 | K丙 |
平衡時AB3的濃度/mol·L-1 | c甲 | c乙 | c丙 |
平衡時AB3的反應速率/mol·L-1·min-1 | v甲 | v乙 | v丙 |
下列說法正確的是
A. v甲=v丙 B. c乙< c丙 C. a甲 +a乙<1 D. K乙≤K丙
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com