
【題目】焦亞硫酸鈉(Na2S2O5)是常用的抗氧化劑,在空氣中,受熱時易分解。實驗室制備少量Na2S2O5的方法:在不斷攪拌下,控制反應溫度在40℃左右,向Na2CO3過飽和溶液中通入SO2,實驗裝置如下圖所示。

當溶液pH約為4時,停止反應。在20℃靜置結晶,生成Na2S2O5的化學方程式為4NaHSO3=2Na2S2O5+2H2O
(1)SO2與Na2CO3溶液反應生成NaHSO3和CO2,其離子方程式為_____________。
(2)裝置Y的作用是___________。
(3)實驗制得的Na2S2O5固體中含有一定量的Na2SO3 和Na2SO4,其可能的原因是_____。
(4)葡萄酒常用Na2S2O5作抗氧化劑。測定某葡萄酒中抗氧化劑的殘留量(以游離SO2計算)的方案如下:

![]()
(已知:滴定時反應的化學方程式為SO2+I2+2H2O===H2SO4+2HI)
①按上述方案實驗,消耗標準I2溶液25.00 mL,該次實驗測得樣品中抗氧化劑的殘留量(以游離SO2計算)為________g·L-1。
②在上述實驗過程中,若有部分HI被空氣氧化,則測定結果________(填“偏高”“偏低”或“不變”)。
【答案】 2SO2 + CO2-3 + H2O = 2HSO3- + CO2 安全瓶,防止倒吸 在制備過程中Na2S2O5分解生成Na2SO3,Na2S2O5被氧化生成Na2SO4 0.16 偏低
【解析】(1)SO2與Na2CO3溶液反應生成NaHSO3和CO2,其離子方程式為2SO2 +CO32- +H2O=2HSO3- +CO2;(2)由于SO2或CO2與氫氧化鈉溶液反應時容易倒吸,所以裝置Y的作用是安全瓶,防止倒吸;(3)由于在制備過程中Na2S2O5分解生成Na2SO3,Na2S2O5被氧化生成Na2SO4,所以實驗制得的Na2S2O5固體中含有一定量的Na2SO3和Na2SO4。(4)①由題設滴定反應的化學方程式知,樣品中抗氧化劑的殘留量(以SO2計算)與I2的物質的量之比為1∶1,n(SO2)=n(I2)=0.01000mol·L-1×0.025L=0.0025mol,殘留量=![]() =0.16g·L-1;②由于實驗過程中有部分HI被氧化生成I2,4HI+O2=2I2+2H2O,導致與SO2反應的I2減少,因此實驗結果偏低。
=0.16g·L-1;②由于實驗過程中有部分HI被氧化生成I2,4HI+O2=2I2+2H2O,導致與SO2反應的I2減少,因此實驗結果偏低。


科目:高中化學 來源: 題型:
【題目】可逆反應mA(s)+nB(g)![]() eC(g)+fD(g)反應過程中,當其他條件不變時,C的體積分數(C)在不同溫度(T)和不同壓強(P)的條件下隨時間(t)的變化關系如圖所示。下列敘述正確的是( )
eC(g)+fD(g)反應過程中,當其他條件不變時,C的體積分數(C)在不同溫度(T)和不同壓強(P)的條件下隨時間(t)的變化關系如圖所示。下列敘述正確的是( )

A. 達到平衡后,若使用催化劑,C的體積分數將增大
B. 當平衡后,若溫度升高,化學平衡向逆反應方向移動
C. 化學方程式中,n>e+f
D. 達到平衡后,增加A的質量有利于化學平衡向正反應方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在“HI(s)→HI(g)→H2和I2”的變化過程中,被破壞的作用力依次是( )
A. 范德華力、范德華力 B. 范德華力、共價鍵
C. 共價鍵、離子鍵 D. 共價鍵、共價鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】生物大分子通常都有一定的分子結構規律,即是由一定的基本結構單位,按一定的排列順序和連接方式形成的多聚體,下列表述正確的是 ( )

A.若該圖為一段肽鏈的結構模式圖,則1表示肽鍵,2表示中心碳原子,3的種類有20種
B.若該圖為一段RNA的結構模式圖,則1表示核糖,2表示磷酸基團,3的種類有4種
C.若該圖為一段單鏈DNA的結構模式圖,則1表示磷酸基團,2表示脫氧核糖,3的種類有4種
D.若該圖表示多糖的結構模式圖,則淀粉、纖維素和糖原是相同的
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 氯氣通入水中,有化學鍵的斷裂與形成
B. MgCl2晶體中存在離子鍵與共價鍵
C. NH3和Cl2兩種分子中,每個原子的最外層都具有8電子穩定結構
D. CO2和SiO2晶體都是由分子構成的
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列分子中中心原子的雜化方式和分子的空間構型均正確的是( )
A. C2H2:sp2、直線形
B. SO42-:sp3、三角錐形
C. H3O+:sp3、V形
D. BF3:sp2、平面三角形
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將0.8g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀鹽酸。下列圖像能正確表示加入鹽酸的體積和生成CO2的物質的量的關系的是
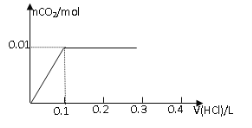
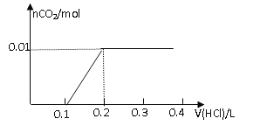
A B
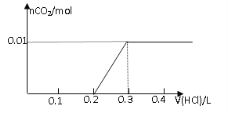
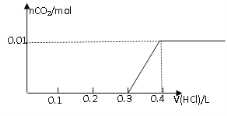
C D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關NaClO和NaCl混合溶液的敘述正確的是( )
A. 該溶液中,H+、NH![]() 、SO
、SO![]() 、Br-可以大量共存
、Br-可以大量共存
B. 該溶液中,Ag+、K+、NO![]() 、CH3CHO可以大量共存
、CH3CHO可以大量共存
C. 向該溶液中滴入少量FeSO4溶液,反應的離子方程式為:2Fe2++ClO-+2H+===Cl-+2Fe3++H2O
D. 向該溶液中加入濃鹽酸,每產生1 mol Cl2,轉移電子約為6.02×1023個
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com