
【題目】可逆反應2NO2(g)![]() 2NO(g)+O2(g)在恒容密閉容器中進行,達到平衡狀態的標志是
2NO(g)+O2(g)在恒容密閉容器中進行,達到平衡狀態的標志是
①單位時間內生成n molO2的同時生成2n mol NO
②單位時間內生成n molO2的同時生成2n mol NO2
③用NO2、NO、O2的物質的量濃度變化表示的反應速率之比為2:2:1的狀態
④混合氣體的顏色不再改變的狀態
⑤混合氣體的密度不再改變的狀態
⑥混合氣體的平均相對分子質量不再改變的狀態.
A. ①③⑤ B. ②④⑥ C. ①③④ D. ①②③④⑤⑥
【答案】B
【解析】①單位時間內生成nmolO2是正反應速率,同時生成2nmolNO也是正反應速率,故不能說明達到平衡狀態,①錯誤;②單位時間內生成nmolO2是正反應速率,同時生成2nmolNO2是逆反應速率,且化學反應速率之比等于化學計量數之比,故正逆反應速率相等,說明達到平衡狀態,②正確;③化學反應速率之比等于化學計量數之比,故用NO2、NO、O2的物質的量濃度變化表示的反應速率的比始終為2:2:1,故不能說明達到平衡狀態,③錯誤;④二氧化氮為紅棕色氣體,一氧化氮和氧氣為無色氣體,故混合氣體的顏色不再改變,說明達到平衡狀態,④正確;⑤密度=![]() ,總質量不變,體積不變,故混合氣體的密度不再改變,不能說明達到平衡狀態,⑤錯誤;⑥平均相對分子質量=
,總質量不變,體積不變,故混合氣體的密度不再改變,不能說明達到平衡狀態,⑤錯誤;⑥平均相對分子質量=![]() ,總質量不變,總物質的量會變,故混合氣體的平均相對分子質量不再改變,說明達到平衡狀態,⑥正確;達到平衡狀態的標志是②④⑥,答案選B。
,總質量不變,總物質的量會變,故混合氣體的平均相對分子質量不再改變,說明達到平衡狀態,⑥正確;達到平衡狀態的標志是②④⑥,答案選B。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】(10分)A是由導熱材料制成的密閉容器,B是一耐化學腐蝕且易于傳熱的氣球.
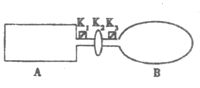
關閉K2,將等量且少量的NO2通過K1、K3分別充入A、B中,反應開始時,A、B的體積相同。已知:2NO2(g)![]() N2O4(g) △H<0。
N2O4(g) △H<0。
(1)一段時間后,反應達到平衡,此時A、B中生成的N2O4的速率是V(A) V(B)(填“<”、“>”或“=”);若打開活塞K2,氣球B將 (填“變大”、“變小”或“不 變”,下同)。
(2)若在A、B中再充入與初始量相等的NO2,則達到平衡時,NO2的轉化率α(A)將 。
若通入等量的Ne氣,則達到平衡時,A中NO2的轉化率將 ,B中NO2的轉化率將 。
(3)室溫時,若A、B都保持體積不變,將A套上一個絕熱層,B與外界可以進行熱傳遞,則達到平衡時, 中的顏色較深。
(4)若在容器A中充入4.6g的NO2,達到平衡后容器內混合氣體的壓強為原來的80%,試求出平衡時NO2的轉化率(寫出計算過程)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述不正確的是
A.不能讓小學生咬鉛筆頭,否則會引起鉛中毒
B.食用堿用于面包加工,可以使面包疏松
C .鋁合金用作門窗框架,這是利用了合金硬度大的特征
D.燒堿和冰醋酸均為電解質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關化學與自然資源的開發利用說法中不正確的是
A. 海水提鎂的過程為:MgCl2(aq)![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
B. 鋁熱反應實驗中,需要用到的試劑有鎂條、氯酸鉀、鋁粉和鐵的氧化物
C. 電解法制備鋁的化學方程式為:2Al2O3 ![]() 4Al + 3O2↑
4Al + 3O2↑
D. 金屬銅的制備一般用熱還原法:H2 + CuO ![]() Cu + H2O
Cu + H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高爐煉鐵過程中發生的主要反應為Fe2O3(s)+CO(g) ![]() Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知該反應在不同溫度下的平衡常數如右表所示:
溫度/℃ | 1 000 | 1 150 | 1 300 |
平衡常數 | 4.0 | 3.7 | 3.5 |
請回答下列問題:
(1)該反應的平衡常數表達式K=____,ΔH____(填“>”“<”或“=”)0.
(2)在一個容積為10 L的密閉容器中,1 000 ℃時加入Fe、Fe2O3、CO、CO2各1.0 mol,反應經過10 min后達到平衡.求該時間范圍內反應的平均反應速率v(CO2)=____、CO的平衡轉化率=____.
(3)欲提高(2)中CO的平衡轉化率,可采取的措施是____.
A.減少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.提高反應溫度 E.減小容器的容積 F.加入合適的催化劑
(4)1000℃時,某時刻CO2和CO的物質的量濃度分別為0.2mol·L-1和0.1mol·L-1,則此時反應是否達到平衡_____(填“是”或“否”),V(正)_____V(逆)(填“>”“<”或“=”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高鐵酸鉀是綠色、環保型水處理劑,也是高能電池的電極材料。工業上利用硫酸亞鐵為原料,通過鐵黃(FeOOH)制備高鐵酸鉀,可降低生產成本且產品質量優。工藝流程如下:

回答下列問題:
(1)有同學認為上述流程可以與氯堿工業聯合。寫出電解飽和食鹽水制取次氯酸鈉的化學方程式______________。
(2)制備鐵黃的離子方程式為_______________。實驗測得反應溶液的pH、溫度對鐵黃產率的影響如圖所示。反應溫度宜選擇_________;pH大于4.5時鐵黃產率逐漸降低的主要原因可能是_______________。

(3)用高鐵酸鉀作水處理劑除了可以對水體進行殺菌消毒之外,其還原產物氫氧化鐵膠體還能吸附水中懸浮雜質,請寫出用高鐵酸鉀除去水體中CN﹣的離子方程式______。
(4)已知:常溫下,Ksp[Fe(OH)3]=4.0×10﹣38。高鐵酸鉀的凈水能力與廢水的pH有關,當溶液pH=2時,廢水中c(Fe3+)=_________molL﹣1。
(5)如果上述流程中,鐵元素總利用率為75%。利用1L 2molL﹣1FeSO4溶液能制備純度為90%的高鐵酸鉀________g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,向20mL0.1mol·L-1H3PO2溶液中滴加0.1mol·L-1的NaOH溶液,滴定曲線如圖1,含磷微粒物質的量濃度所占分數(δ)隨pH變化關系如圖2。下列說法不正確是

A. H3PO2的電離方程式為H3PO2![]() H2PO2-+H+ Ka≈10-5
H2PO2-+H+ Ka≈10-5
B. B點時,溶液中存在關系:2c(H+)+c(H2PO2-)=2c(OH-)+c(H3PO2)
C. C點時,溶液中存在關系:c(Na+)+c(H+)=C(H2PO2-)+c(OH-)
D. D點時,溶液中微粒濃度大小關系:c(Na+)>c(H2PO2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖裝置中X和Y均為石墨電極,電解液為500mL某CuCl2溶液,電解時X電極表面有紅色固體生成,Y電極有氣體產生。一段時間后,取出X電極,洗滌、干燥、稱量,電極增重1.6g。下列有關說法中正確的是
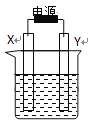
A. X電極連接電源正極
B. 生成氣體體積為0.56L
C. Y電極上發生氧化反應
D. 該CuCl2溶液濃度為0.05mol/L
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com