
【題目】探究Na2O2與水的反應,實驗如圖:(已知:H2O2 ![]() H+ + HO2-、HO2-
H+ + HO2-、HO2- ![]() H+ + O22-)下列分析不正確的是
H+ + O22-)下列分析不正確的是

A. ①、⑤中產生的氣體能使帶火星的木條復燃
B. ①、④中均發生了氧化還原反應和復分解反應
C. ②、⑤中KMnO4與MnO2的作用不同,產生氣體的量也不同
D. 通過③能比較酸性:HCl>H2O2
【答案】D
【解析】
根據實驗探究可以看出,試管①過氧化鈉與水反應生成氫氧化鈉與氧氣,試管②中高錳酸鉀具有氧化性,產生氣體,溶液褪色,則體現了過氧化氫的還原性;試管③中過氧化氫與氯化鋇發復分解反應生成過氧化鋇沉淀與稀鹽酸,試管④中過氧化鋇再與稀硫酸反應生成過氧化氫與硫酸鋇沉淀,試管⑤中探究過氧化氫在二氧化錳催化劑作用下分解生成水和氧氣,據此分析作答。
A. 試管①中過氧化鈉與水反應最終生成氫氧化鈉與氧氣,試管⑤中過氧化氫在二氧化錳催化劑作用下分解生成水和氧氣,因此產生的氣體均能是帶火星的木條復燃,A項正確;
B. ①中的反應機理可以認為過氧化鈉與水反應生成過氧化氫與氫氧化鈉,過氧化氫分解生成水和氧氣,發生的反應為復分解與氧化還原反應,④中過氧化鋇再與稀硫酸反應生成過氧化氫與硫酸鋇沉淀,過氧化氫分解產生了氧氣,因此兩個試管中均發生了氧化還原反應和復分解反應,B項正確;
C. ②中KMnO4與過氧化氫反應生成氧氣,KMnO4體現氧化性,而⑤中MnO2則起催化作用,兩個試管中產生氧氣的量均由過氧化氫的量決定,因溶液是等分的,所以產生氣體的量相同,C項正確;
D. 根據已知條件可以看出過氧化氫屬于二元弱酸,而鹽酸屬于一元強酸。試管③因為生成了過氧化鋇沉淀,不是可溶性的鹽溶液,則不能證明鹽酸與過氧化氫的酸性強弱,D項錯誤;
答案選D。


 小學學習好幫手系列答案
小學學習好幫手系列答案 小學同步三練核心密卷系列答案
小學同步三練核心密卷系列答案科目:高中化學 來源: 題型:
【題目】(1)0.3mol NH3中含有質子數與_________g H2O分子中所含質子數相等。
(2)100mL Al2(SO4)3溶液中c(SO42-)=0.9 mol/L,則n[Al2(SO4)3]=_____________。
(3)10mL 6 mol/L稀硫酸加水稀釋到200mL,稀釋后c(H+)=__________。
(4)已知某飽和NaCl溶液的體積為VmL。密度為ρg/cm3,質量分數為w。物質的量濃度為C mol/L,溶液中含NaCl的質量為m g.
①用m、V表示溶液物質的量濃度__________;
②用w、ρ表示溶液物質的量濃度__________;
③用w表示該溫度下NaCl的溶解度________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】W、X、Y、Z是原子序數依次增大的同一短同期元素,W、X是金屬元素,Y、Z是非金屬元素。
(1)W、X各自的最高價氧化物對應的水化物可以反應生成鹽和水,該反應的離子方程式為_____________
(2)W與Y 可形成化合物W2Y,該化合物的電子式為________________________。
(3)Y的低價氧化物通入Z單質的水溶液中,發生反應的化學方程式為_________________________。Y的最高價氧化物是否滿足8電子穩定結構______________(填是.否)
(4)比較Y、Z氣態氫化物的穩定性由大到小的順序是________________(用分子式表示)。
(5)W、X、Y、Z四種元素簡單離子的離子半徑由大到小的順序是
____________________________________________________。(用離子符號表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】聚酰亞胺是重要的特種工程材料,廣泛應用在航空、納米、激光等領域。某聚酰亞胺的合成路線如下(部分反應條件略去):

已知:
①有機物A的質譜與核磁共振氫譜圖如下:

②
③
回答下列問題:
(1)A的名稱是__________________;C中含氧官能團的名稱是________________。
(2)反應②的反應類型是____________________。
(3)反應①的化學方程式是__________________________。
(4) F的結構筒式是_____________________。
(5)同時滿足下列條件的G的同分異構體共有___________種(不含立體結構);寫出其中一種的結構簡
式:________________。
①能發生銀鏡反應 ②能發生水解反應,其水解產物之一能與FeC13溶液發生顯色反應
③1 mol該物質最多能與8 mol NaOH反應
(6) 參照上述合成路線,以間二甲苯和甲醇為原料(無機試劑任選)設計制備 的合成路線:_______________________。
的合成路線:_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯氣是一種重要的化工原料,自來水的消毒、農藥的生產、藥物的合成都需要用它。
(1)工業上通常采用電解法制氯氣,請觀察圖后回答下列問題:

① 請寫出該反應的化學方程式________________________________。
② 通電后,b側產生的氣體是______![]() 填化學式
填化學式![]() 。
。
(2)某學生設計如圖所示的實驗裝置,利用氯氣與潮濕的消石灰反應制取少量漂白粉![]() 這是一個放熱反應
這是一個放熱反應![]() ,回答下列問題:
,回答下列問題:

①在A裝置中用固體二氧化錳與濃鹽酸,在加熱條件下制取氯氣,請寫出反應的化學方程式________________________________。
②漂白粉將在U形管中產生,其化學方程式是______________________________。
③裝置C的作用是______________。
④此實驗所得漂白粉的有效成分偏低,該學生經分析并查閱資料發現,主要原因是在U形管中還存在兩個副反應:
I.溫度較高時氯氣與消石灰反應生成![]() ,為避免此副反應的發生,可采取的措施是________________________。
,為避免此副反應的發生,可采取的措施是________________________。
II.試判斷另一個副反應![]() 用化學方程式表示
用化學方程式表示![]() ______________________________,為避免此副反應的發生,可以在A與B之間連接一個裝有______的洗氣瓶。
______________________________,為避免此副反應的發生,可以在A與B之間連接一個裝有______的洗氣瓶。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關氧化還原反應的敘述正確的是( )
A.氧化還原反應中有一種元素被氧化時,一定有另一種元素被還原
B.某金屬元素M由化合態變為游離態,M一定被還原
C.用雙線橋表示下列反應的電子轉移
D.非金屬單質在反應中只能作氧化劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有A,B,C,D,E五種元素,其中A,B,C,D為短周期元素,A元素的周期數、主族數、原子序數相同;B原子核外有3種能量不同的原子軌道且每種軌道中的電子數相同;C原子的價電子構型為csccpc+1,D元素的原子最外層電子數比次外層電子數少2個,D的陰離子與E的陽離子電子層結構相同,D和E可形成化合物E2D。
回答下列問題:
(1) C原子的價電子構型為csccpc+1 ,其中c為________, C原子的名稱為__________ ;
(2)上述元素中,第一電離能最小的元素的原子結構示意圖為__________________;
D的價電子排布圖為______________________;E2D的電子式為__________________;
(3) 下列分子結構圖中的●和○表示上述元素的原子中除去最外層電子的剩余部分,小黑點表示沒有形成共價鍵的最外層電子,短線表示共價鍵.
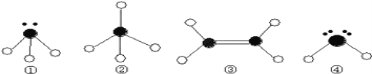
則在以上分子中,中心原子采用sp3雜化形成化學鍵的是___________(填寫分子的化學式);
②分子中的鍵角是_____________; 在③的分子中有_______個σ鍵和_______個π鍵。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】迄今為止我國相關部門已經發布了113號Nh、115號Mc、116號Lv、117號Ts、118號Og等元素的中文名稱分別是:![]() ,下列有關推斷正確的是
,下列有關推斷正確的是
A. 這五種元素均為主族元素
B. 根據該名稱,周期表118種元素中非金屬元素共有24種
C. Nh的最高價氧化物是一種典型的兩性氧化物
D. Ts的簡單陰離子比該族上一周期簡單陰離子的還原性弱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列敘述正確的是
A. 所含共價鍵數均為0.4NA的白磷(P4)和甲烷的物質的量相等
B. 1 mol Na與O2反應,生成Na2O和Na2O2的混合物共失去NA個電子
C. 1mol Na2O2固體中含有離子總數為4NA
D. 25℃時,pH=13的氫氧化鈉溶液中約含有NA個氫氧根離子
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com