
| | Fe | H2O(g) | Fe3O4 | H2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
| | Fe | H2O(g) | Fe3O4 | H2 |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| | Fe | H2O(g) | Fe3O4 | H2 |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1 | 4 |
| C/mol | m | n | p | q |
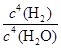 (2)-150.8kJ/mol
(2)-150.8kJ/mol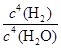 。
。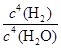 可知
可知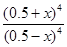 =16
=16 ,所以水蒸氣的轉化率=
,所以水蒸氣的轉化率=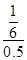 ×100%=33.3%
×100%=33.3%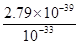 =2.79×10-6mol/L。
=2.79×10-6mol/L。

 能力評價系列答案
能力評價系列答案 唐印文化課時測評系列答案
唐印文化課時測評系列答案科目:高中化學 來源:不詳 題型:填空題
 2SO3(g) ΔH=-196.6 kJ·mol-1反應過程的能量變化示意圖。
2SO3(g) ΔH=-196.6 kJ·mol-1反應過程的能量變化示意圖。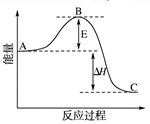
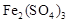 起催化作用,使反應按以下兩步完成:
起催化作用,使反應按以下兩步完成:查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

 CO(NH2)2(l)+H2O(l),該反應的平衡常數和溫度關系如下:
CO(NH2)2(l)+H2O(l),該反應的平衡常數和溫度關系如下:| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
 ?2NH3(g) ΔH2=-92.4 kJ·mol-1
?2NH3(g) ΔH2=-92.4 kJ·mol-1查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
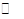 H2O(l)+H2NCONH2(l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2(l) △H=-103.7 kJ·mol-1| A.采用高溫 |
| B.采用高壓 |
| C.尋找更高效的催化劑 |
| D.減小體系內CO2濃度 |
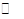 H2NCOONH4(氨基甲酸銨)(l) △H1
H2NCOONH4(氨基甲酸銨)(l) △H1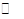 H2O(l)+H2NCONH2(l) △H2.
H2O(l)+H2NCONH2(l) △H2.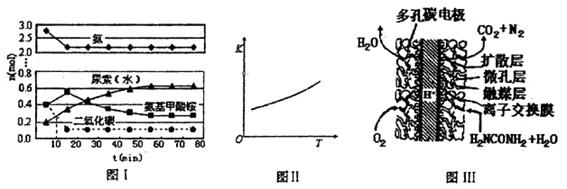
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
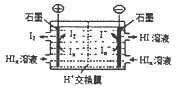
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 2NH3 (g) ΔH =" -92.4" kJ/mol
2NH3 (g) ΔH =" -92.4" kJ/mol
| 反應 | 大氣固氮 | 工業固氮 | ||||
| 溫度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
 2NH3 (g)測得甲容器中H2的轉化率為40%。
2NH3 (g)測得甲容器中H2的轉化率為40%。| | N2 | H2 | NH3 |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:計算題

 。
。 催化還原
催化還原 的方法也可以消除氮氧化物的污染。例如:
的方法也可以消除氮氧化物的污染。例如:查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com