

 。
。 催化還原
催化還原 的方法也可以消除氮氧化物的污染。例如:
的方法也可以消除氮氧化物的污染。例如: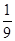 (2分);
(2分);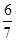 (2分)
(2分) 4CO2+N2(2分)
4CO2+N2(2分)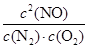 =
=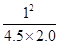 =
=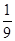
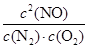 =
=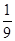 可知
可知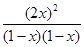 =
=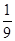
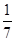
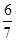 mol/L
mol/L 4CO2+N2。
4CO2+N2。

 智能訓練練測考系列答案
智能訓練練測考系列答案科目:高中化學 來源:不詳 題型:填空題
 W (s) + 3H2O (g)
W (s) + 3H2O (g) | 溫度 | 25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
 W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1  W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1  WO2 (g) 的ΔH = ______________________。
WO2 (g) 的ΔH = ______________________。 WI4 (g)。下列說法正確的有____________。
WI4 (g)。下列說法正確的有____________。查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
| | Fe | H2O(g) | Fe3O4 | H2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
| | Fe | H2O(g) | Fe3O4 | H2 |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| | Fe | H2O(g) | Fe3O4 | H2 |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1 | 4 |
| C/mol | m | n | p | q |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
| 化學式 | HF | H2CO3 | HClO |
| 電離平衡常數 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
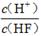 D.
D.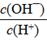
查看答案和解析>>
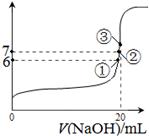
科目:高中化學 來源:不詳 題型:計算題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:推斷題
 X(g);△H=-dJ·mol-1(d>0,X為A、B、C三種元素組成的一種化合物)。初始投料與各容器達到平衡時的有關數據如下:
X(g);△H=-dJ·mol-1(d>0,X為A、B、C三種元素組成的一種化合物)。初始投料與各容器達到平衡時的有關數據如下:| 實驗 | 甲 | 乙 | 丙 |
| 初始投料 | 2 molA2、1 molBC | 1 molX | 4 molA2、2 molBC |
| 平衡時n(X) | 0.5mol | n2 | n3 |
| 反應的能量變化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 體系的壓強 | P1 | P2 | P3 |
| 反應物的轉化率 | α1 | α2 | α3 |

查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 2CO(g)+2H2(g)。平衡體系中各組分體積分數如下表:
2CO(g)+2H2(g)。平衡體系中各組分體積分數如下表:| 物質 | CH4 | CO2 | CO | H2 |
| 體積分數 | 0.1 | 0.1 | 0.4 | 0.4 |
 2CO(g)+2H2(g) 的△H= 。
2CO(g)+2H2(g) 的△H= 。
查看答案和解析>>
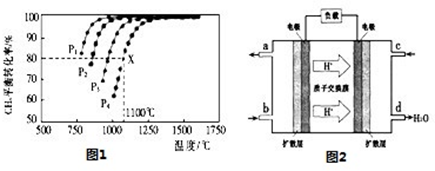
科目:高中化學 來源:不詳 題型:計算題
 Fe3O4(s)+4H2(g) △H=akJ/mol (I)
Fe3O4(s)+4H2(g) △H=akJ/mol (I) 6FeO(s)+O2(g) △H=bkJ/mol (II)
6FeO(s)+O2(g) △H=bkJ/mol (II)
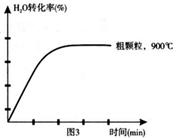
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com