
(10分)某研究性學習小組同學向Fe(NO3)3溶液中滴加淀粉KI溶液后,溶液呈藍色。他們對Fe(NO3)3溶液中將I-氧化的氧化劑進行了如下探究:
【實驗】分別向FeCl3溶液和HNO3溶液中滴加淀粉KI溶液后,發現溶液均顯藍色。
(1)FeCl3溶液與KI溶液反應的離子方程式為 。
(2)KI與HNO3反應的離子方程式為I-+H++NO3-→NO↑+I2+H2O(未配平),反應中氧化劑與還原劑的物質的量之比為 。
【提出假設】假設1:氧化劑只有Fe3+ 假設2:氧化劑只有NO3-(H+)
【設計實驗方案,驗證假設】
(3)請設計實驗驗證上述假設
供選試劑:0.2mol?L-1的Fe(NO3)3溶液、0.2mol?L-1的KI溶液、0.01mol?L-1的KMnO4酸性溶液、0.01mol?L-1的KSCN溶液、CCl4溶液、淀粉溶液。(提示:NO3-在不同條件下的還原產物較復雜,有時難以觀察到氣體產生)
| 實驗步驟 | 預期現象和結論 |
| ①取5ml0.2mol?L-1的Fe(NO3)3溶液和5ml0.2mol?L-1的KI溶液,充分反應后加入5ml CCl4溶液,振蕩靜置,取上層溶液,分置于A、B兩支試管中 | |
| ② ③ | 若溶液不變紅色,則假設1成立,否則假設1不成立; 若溶液顯紫色,則假設2成立,否則假設2不成立 |
(1)2 Fe3++2 I-=2 Fe2++I2;(2)1﹕3;
(3)
(4)步驟②中溶液變紅色,步驟③中溶液不顯紫色。實驗步驟 預期現象和結論 ②向試管A中加入1 ~ 2滴0.01 mol?L-1的KSCN溶液(2分)
③向試管B中加入1 ~ 2滴0.01 mol?L-1的
KMnO4酸性溶液(2分)
解析試題分析:(1)FeCl3溶液與KI溶液反應的離子方程式為2 Fe3++2 I-=2 Fe2++I2;(2)在該反應中I-作還原劑,化合價由反應前的-1價變為反應后的0價,化合價升高1價,氧化劑是NO3-化合價由反應前的+5價變為反應后NO的+2價,化合價降低。根據氧化還原反應中化合價升降總數相等,可知氧化劑與還原劑的物質的量的比是1﹕3;(3)②向試管A中加入1 ~ 2滴0.01 mol?L-1的KSCN溶液,若溶液不變紅色,則假設1成立,否則假設1不成立;③向試管B中加入1 ~ 2滴0.01 mol?L-1的KMnO4酸性溶液,若溶液顯紫色,則假設2成立,否則假設2不成立;(4)若Fe(NO3)3與KI反應的過程中,Fe3+和NO3-(H+)均參與氧化I-,則上述實驗中步驟②預期現象是溶液變紅色;③的預期現象是溶液不顯紫色。
考點:考查Fe(NO3)3溶液中滴加淀粉KI溶液反應原理的知識。


科目:高中化學 來源: 題型:填空題
向盛有KI溶液的試管中加入少許CC14后滴加氯水,CCl4層變成紫色。如果繼續向試管中滴加氯水,振蕩,CC14層會逐漸變淺,最后變成無色。完成下列填空:
(1)上述過程CCl4層在試管中位于 (填上、下)層,分離CC14層和水層的操作名稱是____ ,使用的玻璃儀器是 。
(2)寫出并配平CC14層由紫色變成無色的化學反應方程式(如果系數是l不用填寫);
+ + → HIO3+
(3)把KI換成KBr。則CC14層變為 色,該反應的離子方程式為 。繼續滴加氯水,CCl4層的顏色沒有變化。Cl2、 HIO3、HBrO3氧化性由強到弱的順序是 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
高錳酸鉀和二氧化錳是中學化學常用的化學試劑。根據下面相關的信息回答下列問題:
(1)已知: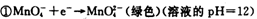
②
錳有多種化合價,如+7、十6、+4、+2價等,在中性溶液里高錳酸鉀的還原產物為 (填化學式)。
(2)查閱相關資料:發生如下反應(反應未配平):
已知在高錳酸鉀固體表面滴加濃鹽酸,發生的半反應為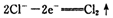
如果在盛有氯化錳溶液的試管中加入適量XeO3,振蕩試管,可能觀察到的現象是 。
(3)已知草酸(H2C2O4)為二元弱酸,取少量草酸晶體溶于酸性高錳酸鉀溶液,溶液的紫色褪去。
寫出該反應的離子方程式 。
(4)MnO2是一種重要的無機功能材料,制備MnO2的方法之一是以石墨為電極,電解酸化的MnSO4溶液,陽極的電極反應式為 。現以鉛蓄電池為電源電解酸化的MnSO4溶液,如圖所示,鉛蓄電池的總反應方程式為 ,當蓄電池中有4mol H+被消耗時,則電路中通過的電子的物質的量為 ,MnO2的理論產量為 g。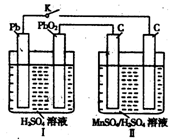
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
工業上由鋁土礦(主要成分是Al2O3和Fe2O3)和焦炭制備無水AlCl3的流程如下
已知:AlCl3,FeCl3,分別在183℃、315℃升華
(1)在焙燒爐中發生反應:
①Fe2O3(s)+3C(s)  2Fe(s)+3CO(g) △H=-492.7kJ/mol
2Fe(s)+3CO(g) △H=-492.7kJ/mol
②3CO(g)+ Fe2O3(s) 2Fe(s)+3CO2(g) △H=+25.2kJ/mol
2Fe(s)+3CO2(g) △H=+25.2kJ/mol
反應2Fe2O3(s)+3C(s) 4Fe(s)+3CO2(g) △H=___________kJ/mol。
4Fe(s)+3CO2(g) △H=___________kJ/mol。
(2)①Al2O3,Cl2和C在氯化爐中高溫下發生反應,當生成1molAlCl3。時轉移______mol電子;爐氣中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其離子方程式為:____________________________。在溫度約為700℃向升華器中加入鋁粉,發生反應的化學方程式為_______________。充分反應后溫度降至____________以下(填“183℃、315℃之一),開始分離收集AlCl3。
②將AlCl3· 6H2O溶于濃硫酸進行蒸餾,也能得到一定量的無水AlCl3,此原理是利用濃硫酸下列性質中的____(填字母序號)。
①氧化性 ②吸水性 ③難揮發性 ④脫水性
a.只有① b.只有② c.只有②③ d.只有②③④
(3)海洋燈塔電池是利用鋁、石墨為電極材料,海水為電解質溶液,構成電池的其正極反應式 ________;與鉛蓄電池相比.釋放相同電量時,所消耗金屬電極材料的質量比m(Al):m(Pb)=_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
(14分)黃銅礦是工業煉銅的主要原料,其主要成分為CuFeS2,現有一種天然黃銅礦(含少量脈石SiO2),為了測定該黃銅礦的純度,某同學設計了如下實驗: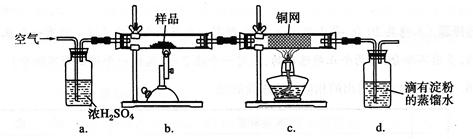

現稱取研細的黃銅礦樣品1.150 g,在空氣存在下進行煅燒,生成Cu、Fe2O3、FeO和SO2氣體,實驗后取d中溶液的1/10置于錐形瓶中,用0.05000 mol·L-1標準碘溶液進行滴定,初讀數為0.10 mL,末讀數如右圖所示。
(1)冶煉銅的反應為8CuFeS2+ 21O2 高溫8Cu + 4FeO + 2Fe2O3+ 16SO2,若CuFeS2中Fe的化合價為+2,反應中被還原的元素是 (填元素符號)。
(2)裝置a的作用是 。
| A.有利于空氣中氧氣充分反應 | B.除去空氣中的水蒸氣 |
| C.有利于氣體混合 | D.有利于觀察空氣流速 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
某化學興趣小組在探究鹵素單質的氧化性的實驗中發現,在足量的氯化亞鐵溶液中,加入1~2滴溴水,振蕩后溶液呈黃色,原因是什么?Br2能否氧化Fe2+,Fe3+與Br2誰的氧化性更強?
(1)甲同學認為:Br2不能氧化Fe2+,Fe3+的氧化性大于Br2,產生上述現象的原因不是化學反應所致,溶液呈黃色是含 (填化學式,下同)所致。
(2)乙同學認為:Br2將Fe2+氧化為Fe3+,Fe3+的氧化性小于Br2,產生上述現象的原因是化學反應所致,則溶液呈黃色是含 所致。
(3)丙同學為驗證乙同學的觀點,選擇下列試劑,設計出兩種方案進行實驗,并通過觀察實驗現象,證明了乙同學的觀點是正確的,供選用的試劑:a.酚酞試劑;b.CCl4;c.無水酒精;d.KSCN溶液。請你在下表中寫出丙同學選用的試劑及實驗中觀察到的現象。(試劑填序號)
| 選用試劑 | 實驗現象 |
| 方案1 | |
| 方案2 | |
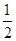 的Br-被氧化成單質Br2,則原FeBr2溶液的物質的量濃度是 。
的Br-被氧化成單質Br2,則原FeBr2溶液的物質的量濃度是 。查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
為驗證氧化性Cl2>Fe3+>SO2,某小組用下圖所示裝置進行實驗(夾持儀器和甲中加熱裝置已略,氣密性已檢驗)。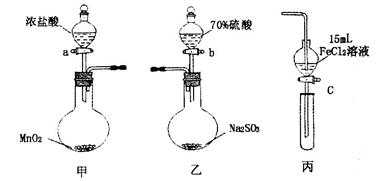
實驗步驟:
1.在甲裝置中,打開活塞a,加熱,待裝置中充滿黃綠色氣體時,與丙裝置連接。
2.當丙裝置中FeC12溶液變黃時,停止加熱。
3.打開活塞c,使約2mL的溶液滴入試管中,檢驗溶液中的離子。
4.在乙裝置中,打開活塞b,待空氣排盡后,將乙中產生的氣體通入上述丙裝置變黃后的溶液中,一段時間后,停止。
5.更新丙中試管,打開活塞c,使約2mL的溶液滴入試管中,檢驗溶液中的離子。
回答下列問題:
(1)甲中發生反應的化學方程式為______________________。
(2)用70%的硫酸制取SO2,反應速率比用98%的硫酸快,原因是____________。
(3)實驗中,證明氧化性Fe3+>SO2的離子方程式為_____________。
(4)有I、II、III三組同學分別完成了上述實驗,實驗結果如下:
| | 步驟3溶液中含有的離子 | 步驟5溶液中含有的離子 |
| I | 既有Fe3+又有Fe2+ | 有SO42- |
| Ⅱ | 有Fe3+無Fe2+ | 有SO42- |
| Ⅲ | 有Fe3+無Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
Na2SO3在空氣中易被氧化而變質。某同學為證明Na2SO3有還原性,從一瓶實驗室長期存放的Na2SO3固體中取出少量溶于水,滴入一定量的燒堿溶液和少許溴水,振蕩后溶液變為無色。
(1)在堿性溶液中Br2和Na2SO3反應的離子方程式 。
(2)反應后的溶液含有SO32-、SO42-、Br-、OH-等陰離子,下表是某同學鑒定其中SO32-、SO42-和Br-的實驗報告,請完成未填完的部分。
限選試劑:2 mol·L-1HCl;1 mol·L-1 H2SO4;l mol·L-1BaCl2;l mol·L-1Ba(NO3)2;1 mol·L-1 KMnO4、CCl4;新制飽和氯水;品紅溶液。
| 編號 | 實驗操作 | 預期現象和結論 |
| 步驟① | 取少量待測液加入試管中,加入過量2mol·L-1HCl,再滴加適量1 mol·L-1BaCl2 溶液。 | 有白色沉淀生成,證明待測液中含有、SO42- 。 |
| 步驟② | | |
| 步驟③ | | |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
把一塊鎂鋁合金投入到1 mol/L酸中,待合金完全溶解后,再往溶液里加入1 mol/L NaOH溶液,生成沉淀的物質的量隨加入NaOH溶液的體積變化的關系如下圖所示,下列說法中錯誤的是( )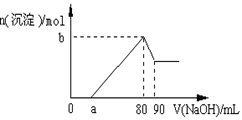
| A.鹽酸的體積為80ml | B.a的取值范圍為0≤ a <50 |
| C.n(Mg2+)<0.025mol | D.當a值為30時,b值為0.01 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com