
【題目】2014年5月7日,天津某工程檢測公司在進行探傷作業期間,一枚黃豆粒大小的放射源銥-192丟失,造成了嚴重的安全事故,圖示是銥在元素周期表中的信息,下列說法正確的是( )
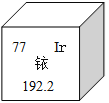
A. 銥的相對原子質量為192.2克
B. 銥原子核內的中子數為77
C. K2IrO3中Ir的化合價為+4
D. 生活中常用的銥金筆為純凈的銥單質
科目:高中化學 來源: 題型:
【題目】鋁熱反應不僅用于焊接鋼軌,而且還常用于冶煉熔點較高的金屬如釩、鉻、錳等。
請配平下列用鋁熱反應冶煉金屬釩和鈷的化學方程式,指出哪些物質是還原劑、哪些物質是氧化劑,并計算生成1 mol各種金屬分別需要純鋁的質量。
V2O5+Al——Al2O3+V Co3O4+Al——Al2O3+Co
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于金屬腐蝕與防護的說法不正確的是
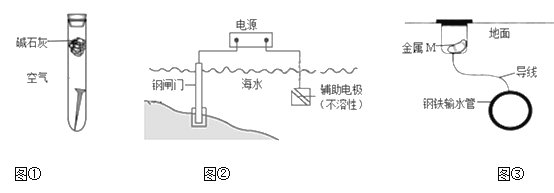
A. 圖①,放置于干燥空氣中的鐵釘不易生銹
B. 圖②,若將鋼閘門與電源的正極相連,可防止鋼閘門腐蝕
C. 圖②,若斷開電源,鋼閘門將發生吸氧腐蝕
D. 圖③,若金屬M比Fe活潑,可防止輸水管腐蝕
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用酸性KMnO4和H2C2O4(草酸)反應研究影響反應速率的因素。一實驗小組欲通過測定單位時間內生成CO2的速率,探究某種影響化學反應速率的因素,設計實驗方案如下(KMnO4溶液已酸化):
實驗序號 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |

(1)該反應的離子方程式 。(已知H2C2O4是二元弱酸)
(2)該實驗探究的是 因素對化學反應速率的影響。相同時間內針筒中所得CO2的體積大小關系是 < (填實驗序號)。
(3)若實驗①在2 min末收集了2.24 mL CO2(標準狀況下),則在2 min末, c(MnO4-)=__________mol/L(假設混合液體積為50 mL)
(4)除通過測定一定時間內CO2的體積來比較反應速率,本實驗還可通過測定 來比較化學反應速率。(一條即可)
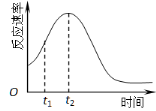 (5)小組同學發現反應速率總是如圖,其中t1~t2時間內速率變快的主要原因可能是:
(5)小組同學發現反應速率總是如圖,其中t1~t2時間內速率變快的主要原因可能是:

① ;② 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素A、B、C、D的位置如右圖所示, B、C兩元素的原子序數之和是A元素原子序數的4倍,各元素對應的物質相互比較,其中關系正確的是

A.原子半徑:C>D>AB.單質的熔點:B>C,D>A
C.最高正價:B>D=A>CD.氣態氫化物的穩定性:B>C,D>A
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請按如圖所示要求,完成下列實驗:
實驗①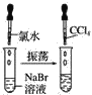
實驗②
實驗③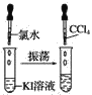
(1)實驗①靜置后,觀察到實驗現象是__,反應的化學方程式是__。
(2)實驗②靜置后,觀察到實驗現象是__,反應的化學方程式是__。
(3)實驗③靜置后,觀察到實驗現象是__,反應的化學方程式是__。
(4)通過上述實驗可知,鹵素單質氧化性由強到弱的順序是__,鹵素陰離子的還原性由強到弱的順序是__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(一)鉛蓄電池是典型的二次電池,電池總反應式為:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。請回答下列問題(不考慮氫、氧的氧化還原):放電時,正極的電極反應式是____________________________。當外電路通過1 mol電子時,理論上負極板的質量增加______g。
2PbSO4+2H2O。請回答下列問題(不考慮氫、氧的氧化還原):放電時,正極的電極反應式是____________________________。當外電路通過1 mol電子時,理論上負極板的質量增加______g。
(二)某研究性學習小組,為了探究電極與原電池的電解質之間關系,設計了下列實驗方案:用鋁片、銅片、鎂片作電極,分別與下列溶液構成原電池,并接電流表。
(1)若用HNO3(濃)作電解質溶液,電極為銅片和鋁片,正極上發生的電極反應式為________________;
(2)若電解質溶液為0.5mol/LNaOH溶液,電極為鎂片和鋁片,則負極的電極反應式為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表中各組物質不能實現如圖所示轉化的是
![]()
選項 | 甲 | 乙 | 丙 |
A | CO2 | NaHCO3 | Na2CO3 |
B | AlCl3 | Al2O3 | NaAlO2 |
C | AlCl3 | Al | Al(OH)3 |
D | AlCl3 | Al(OH)3 | NaAlO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年諾貝爾化學獎授予約翰·古德伊納夫、斯坦利·惠廷厄姆和吉野彰三位科學家,以表彰他們在鋰電池領域所做出的巨大貢獻。![]() 、
、![]() 常用作鋰離子電池的正極材料,請回答下列問題:
常用作鋰離子電池的正極材料,請回答下列問題:
(1)基態鋰原子的最高能級的電子云形狀是________;基態磷原子有________個未成對電子;基態鐵原子核外電子排布式為________。
(2)![]() 中
中![]() 的配位數為4,配體中N的雜化方式為________,該配離子中各元素的第一電離能由小到大的順序為________(用元素符號表示)。
的配位數為4,配體中N的雜化方式為________,該配離子中各元素的第一電離能由小到大的順序為________(用元素符號表示)。
(3)![]() 在水中易被還原成
在水中易被還原成![]() ,而在氨水中可穩定存在,其原因為________。
,而在氨水中可穩定存在,其原因為________。
(4)![]() 屬于簡單磷酸鹽,而直鏈的多磷酸鹽則是一種復雜磷酸鹽,如:焦磷酸鈉、三磷酸鈉等。焦磷酸根離子、三磷酸根離子如下圖所示:
屬于簡單磷酸鹽,而直鏈的多磷酸鹽則是一種復雜磷酸鹽,如:焦磷酸鈉、三磷酸鈉等。焦磷酸根離子、三磷酸根離子如下圖所示:

這類磷酸根離子的化學式可用通式表示為________(用n代表P原子數)。
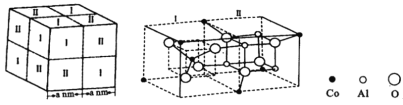
(5)鈷藍晶體結構如下圖,該立方晶胞由4個Ⅰ型和4個Ⅱ型小立方體構成。晶體中![]() 占據
占據![]() 形成的________(填“四面體空隙”或“八面體空隙”);鈷藍晶體的密度為___________
形成的________(填“四面體空隙”或“八面體空隙”);鈷藍晶體的密度為___________![]() (列出計算式,用
(列出計算式,用![]() 表示阿伏加德羅常數的值)。
表示阿伏加德羅常數的值)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com