
【題目】利用CO和H2在催化劑的作用下合成甲醇,反應如下:CO(g)+2H2(g)![]() CH3OH(g)。在2L密閉容器中充入物質的量之比為1:2的CO和H2,在催化劑作用下充分反應,測得平衡混合物中CH3OH的體積分數在不同壓強下隨溫度的變化如圖所示。下列說法正確的是
CH3OH(g)。在2L密閉容器中充入物質的量之比為1:2的CO和H2,在催化劑作用下充分反應,測得平衡混合物中CH3OH的體積分數在不同壓強下隨溫度的變化如圖所示。下列說法正確的是
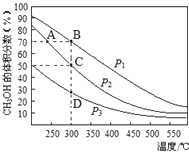
A.該反應的△H<0,且p1<p2<p3
B.在C點時,H2轉化率為75%
C.反應速率:ν逆(狀態A)>ν逆(狀態B)
D.在恒溫恒壓條件下,向該密閉容器中再充入1molCH3OH,達平衡時CH3OH的體積分數增大
【答案】B
【解析】
試題分析:A.由圖可知,升高溫度,CH3OH的體積分數減小,平衡逆向移動,則該反應的△H<0,300℃時,增大壓強,平衡正向移動,CH3OH的體積分數增大,所以p1>p2>p3,故A錯誤;B.設向密閉容器充入了1molCO和2molH2,CO的轉化率為x,則
CO(g)+2H2(g)═CH3OH(g)
起始 1 2 0
變化 x 2x x
結束 1-x 2-2x x
在C點時,CH3OH的體積分數=![]() =0.5,解得x=0.75,則H2的轉化率為75%,故B正確;C.B點對應的溫度和壓強均大于A點,溫度升高、增大壓強均使該反應的化學反應速率加快,因此ν逆(狀態A)<ν逆(狀態B),故C錯誤;D.由等效平衡可知,在恒溫恒壓條件下向密閉容器中1mol的CH3OH,達平衡時CH3OH的體積分數相同,故D錯誤;故選B。
=0.5,解得x=0.75,則H2的轉化率為75%,故B正確;C.B點對應的溫度和壓強均大于A點,溫度升高、增大壓強均使該反應的化學反應速率加快,因此ν逆(狀態A)<ν逆(狀態B),故C錯誤;D.由等效平衡可知,在恒溫恒壓條件下向密閉容器中1mol的CH3OH,達平衡時CH3OH的體積分數相同,故D錯誤;故選B。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】在一定溫度下,將氣體X和氣體Y 各0.16 mol充入10 L 恒容密閉容器中,發生反應
X(g)+ Y(g)![]() 2Z(g) △H < 0,一段時間后達到平衡。反應過程中測定的數據如下表。下列說法正確的是( )
2Z(g) △H < 0,一段時間后達到平衡。反應過程中測定的數據如下表。下列說法正確的是( )
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反應前2min的平均速率v(Z)=2.0×10-5 mol/(L·min)
B.其他條件不變,降低溫度,反應達到新平衡前v(逆)>v(正)
C.該溫度下此反應的平衡常數K=1.44
D.其他條件不變,再充入0.2 mol Z,平衡時X的體積分數增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過氧化鈉可作為氧氣的來源。常溫常壓下二氧化碳和過氧化鈉反應后,若固體質量增加了28g,反應中有關物質的物理量正確的是(NA表示阿伏加德羅常數)( )
選項 | 二氧化碳 | 碳酸鈉 | 轉移的電子 |
A | 1mol | 2NA | |
B | 22.4L | 1mol | |
C | 106g | 1mol | |
D | 106g | 2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質的沸點由高到低排列的是
①CH3(CH2)2CH3
②CH3(CH2)3CH3
③(CH3)3CH
④(CH3)2CHCH2CH3.
A. ④②①③
B. ②④①③
C. ④①②③
D. ②④③①
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E五種元素,已知:
①A原子的最外層電子數是次外層電子數的兩倍,B的陰離子與C的陽離子跟氖原子的電子層結構相同,E原子的M層上的電子數比K層多5。
②常溫下B2是氣體,它對氫氣的相對密度是16。
③C的單質在B2中燃燒,生成淡黃色固體F。F與AB2反應可生成B2。
④D的單質在B2中燃燒,發出藍紫色火焰,生成有刺激性氣味的氣體DB2。D在DB2中的含量為50%。根據以上情況回答:
(1)E位于第 周期 族; ]
(2) C的離子結構示意圖是 ,F中的化學鍵為 ;
(3) AB2的電子式為 ; F和AB2反應的化學方程式為 ;
(4) C、D、E三種元素的原子半徑從小到大的順序為 ; (用元素符號回答)
(5)常溫下,E的單質與C的最高價氧化物對應水化物的水溶液反應的離子方程式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海水開發利用的部分過程如圖所示。下列說法不正確的是( )
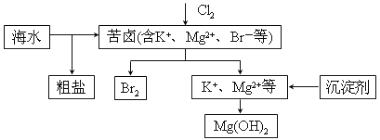
A.向苦鹵中通入Cl2是為了提取溴
B.粗鹽可采用除雜和重結晶等過程提純
C.工業生產常選用NaOH作為沉淀劑
D.富集溴一般先用空氣和水蒸氣吹出單質溴,再用SO2將其還原吸收
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】早期發現的一種天然二十面體準晶顆粒由Al、Cu、Fe三種金屬元素組成。回答下列問題:
(1)準晶是一種無平移周期序,但有嚴格準周期位置序的獨特晶體,可通過________方法區分晶體、準晶體和非晶體。
(2) 鐵元素位于元素周期表中的第 族,在水溶液中常以Fe2+、Fe3+的形式存在,其中 更穩定。基態Fe原子有________個未成對電子。
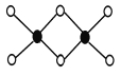
(3)工業上冶煉鋁不用氯化鋁,因為氯化鋁易升華,其雙聚物Al2Cl6結構如圖所示。1mol該分子中含 個配位鍵,該分子 (填“是”或“否”)平面型分子。
(4) Fe(CO)5 是一種配位化合物,該物質常溫下呈液態,熔點為一20.5℃,沸點為103℃,易溶于非極性溶劑。據此可判斷:該化合物的晶體中存在的作用力有( )
A.離子鍵 B.極性鍵 C.非極性鍵 D.范德華力 E.氫鍵 F.配位鍵
(5)很多金屬鹽都可以發生焰色反應,其原因是 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com