
【題目】實驗室采用HCl氣體“置換”除水,升華相結合的方法從市售的氯化鋅制備高純度無水氯化鋅,裝置如圖所示[市售氯化鋅含Zn(OH)Cl]。下列說法不正確的是

A. 恒壓漏斗的作用是平衡氣體壓強
B. 管式爐Ⅰ采取的升溫方式是階段式升溫
C. 實驗時,應先撒去管式爐Ⅰ,再撤去管式爐Ⅱ
D. 在尾氣吸收裝置前應增加一個干燥裝置
【答案】C
【解析】A項,恒壓分液漏斗可以保證內部壓強不變,保持恒壓分液漏斗與三頸瓶內壓強相等,使濃硫酸順利滴下,故A正確;B項,裝置中干燥的HCl氣體從左邊進入管式爐I,與Zn(OH)Cl反應生成氯化鋅和H2O(g),H2O(g)隨HCl氣流進入尾氣吸收裝置,然后管式爐I升至更高的溫度使氯化鋅升華進入管式爐II,凝華得到高純度無水氯化鋅,所以管式爐Ⅰ采取的升溫方式是階段式升溫,故B正確;C項,氯化鋅升華進入管式爐II,凝華得到高純度無水氯化鋅,所以實驗時應先撤去管式爐Ⅱ的加熱,再撒去管式爐Ⅰ,故C錯誤;D項,為防止氯化鋅吸水再次生成Zn(OH)Cl,在尾氣吸收裝置前應增加一個干燥裝置,故D正確。


科目:高中化學 來源: 題型:
【題目】下列屬于分子晶體的一組物質是( )
A. CaO、NO、CO B. CCl4、H2O、He
C. CO2、SO2、NaCl D. CH4、O2、Na2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“氫能”是未來最理想的新能源。
(1)實驗測得,1 g氫氣燃燒生成液態水時放出142.9 kJ熱量,則氫氣燃燒熱的熱化學方程式為________(填選項字母)。
A.2H2(g)+O2(g)=2H2O(l) ΔH=-142.9 kJ·mol-1
B.H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
C.2H2O+O2=2H2O(l) ΔH=-571.6 kJ·mol-1
D.H2(g)+![]() O2(g)=H2O(g) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-285.8 kJ·mol-1
(2)某化學家根據“原子經濟”的思想,設計了如下制備H2的反應步驟:
①CaBr2+H2O![]() CaO+2HBr
CaO+2HBr
②2HBr+Hg![]() HgBr2+H2
HgBr2+H2
③HgBr2+________![]() ________+________
________+________
④2HgO![]() 2Hg+O2↑
2Hg+O2↑
請你根據“原子經濟”的思想完成上述步驟③的化學方程式:_____________;請根據“綠色化學”的思想評估該方法制H2的主要缺點:___________。
(3)利用核能把水分解制氫氣,是目前正在研究的課題。下圖是其中的一種流程,其中用了過量的碘。

請寫出化學方程式:
反應①__________________________。
反應②__________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】800℃時,a、b、c三種氣態物的濃度隨時間變化的情況如圖,由 圖分析不能得出的結論是( )

A. a是反應物
B. 正反應是一個體積擴大的反應
C. 若升高溫度,a的轉化率增大
D. 若增大壓強,a的轉化率減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中科院董紹俊課題組將二氧化錳和生物質置于一個由濾紙制成的折紙通道內形成電池(如圖所示),該電池可將可樂(pH=2.5)中的葡萄糖作為燃料轉化成葡萄糖內酯并獲得能量。下列說法正確的是( )

A. a極為正極
B. 隨著反應不斷進行,負極區的pH不斷增大
C. b極的電極反成為:MnO2+2H2O+2e-=Mn2++4OH-
D. 當消耗0.01mol葡萄糖時,電路中轉移0.02mol電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某容積固定的密閉容器中發生可逆反應:A (g)+2B (g)![]() C (s)+D (g),能說明反應已達到平衡狀態的事實是
C (s)+D (g),能說明反應已達到平衡狀態的事實是
A. 容器內A、B、C、D四者共存 B. νA(正)=2νB(逆)
C. 容器內各種物質的濃度不再改變 D. νA(正)=νC(逆)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知25 ℃時,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10,現向1 L 0.2 mol·L-1HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,則下列說法中,正確的是
A. 25 ℃時,0.1 mol·L-1 HF溶液中pH=1
B. Ksp(CaF2)隨溫度和濃度的變化而變化
C. 該體系中沒有沉淀產生
D. 該體系中HF與CaCl2反應產生沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖在試管甲中先加入2mL 95%的乙醇,并在搖動下緩緩加入2mL濃硫酸,充分搖勻,冷卻后再加入少量無水乙酸,用玻璃棒充分攪拌后將試管固定在鐵架臺上,在試管乙中加入5mL飽和的碳酸鈉溶液,按圖連接好裝置,用酒精燈對試管甲小火加熱3~5min后,改用大火加熱,當觀察到乙試管中有明顯現象時停止實驗。試回答:

(1)試管乙中觀察到的現象是______________________。
(2)液體混合加熱時液體容積不能超過其容積_____,本實驗反應開始時用小火加熱的原因是__________;(已知乙酸乙酯的沸點為77℃;乙醇的沸點為78.5℃;乙酸的沸點為117.9℃)
(3)試管甲中加入濃硫酸的目的是__________。
(4)該實驗中長導管的作用是_______,其不宜伸入試管乙的溶液中,原因是________。
(5)試管乙中飽和Na2CO3的作用是______________________________________。
(6)寫出試管甲中發生反應的化學方程式________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種生物電化學方法脫除水體中NH4+的原理如下圖所示:
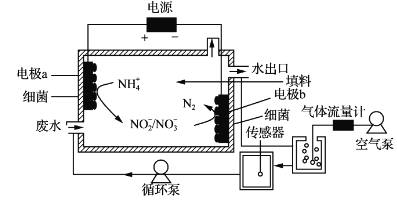
下列說法正確的是
A. 裝置工作時,化學能轉變為電能
B. 裝置工作時,a極周圍溶液pH降低
C. 裝置內工作溫度越高。NH4+脫除率一定越大
D. 電極b上發生的反應之一是:2NO3--2e-=N2↑+3O2↑
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com