
【題目】已知某透明澄清的溶液中可能含有NO3- 、Cl- 、SO42-、CO32-、NH4+、Fe3+、Al3+和K+中的幾種,且所含陰離子的物質的量相等。為確定該溶液的成分,某學習小組做了如下實驗:①取該溶液100mL,加入過量NaOH溶液,加熱得到0.02mol氣體,同時產生紅褐色沉淀; ②將沉淀過濾、洗滌、灼燒,得到1.6 g固體; ③向上述濾液中加入足量BaCl2溶液,得到4.66 g不溶于鹽酸的沉淀。下列說法正確的是
A. 不能確定原溶液中是否含有Al3+和K+
B. 原溶液中含有的離子只有:Cl- 、SO42-、NH4+、Fe3+
C. 原溶液中c(NO3-)=0.2 mol·L-1 c(Fe3+)=0.2 mol·L-1
D. 在原溶液中加入足量的鐵粉所得溶液中陽離子所帶正電荷數(shù)減少
【答案】C
【解析】①取該溶液100mL,加入過量NaOH溶液,加熱得到0.02mol氣體,說明溶液中含有0.02mol NH4+,同時產生紅褐色沉淀為氫氧化鐵,說明溶液中含有Fe3+,CO32-與Fe3+會發(fā)生雙水解而不能大量共存,故溶液中一定不含CO32-;②將沉淀過濾、洗滌、灼燒,得到1.6 g固體為氧化鐵,則n[Fe(OH)3]=2n(Fe2O3)=2×![]() =0.02mol; ③向上述濾液中加入足量BaCl2溶液,得到4.66 g不溶于鹽酸的沉淀,則沉淀為硫酸鋇,n(SO42-)=n(BaSO4)=
=0.02mol; ③向上述濾液中加入足量BaCl2溶液,得到4.66 g不溶于鹽酸的沉淀,則沉淀為硫酸鋇,n(SO42-)=n(BaSO4)= ![]() =0.02mol。n(+)=n(NH4+)+3n(Fe3+)=0.02mol+3×0.02mol=0.08mol,n(-)=2 n(SO42-)=2×0.02mol=0.04mol<0.08mol,故溶液中還有其他陰離子,且所含陰離子的物質的量相等,故n(-)=2 n(SO42-)+n(NO3-)+n(Cl-)=2×0.02mol+0.02mol+0.02mol=0.08mol,因此溶液中一定含有NO3- 、Cl-,一定不含Al3+和K+。故A.原溶液中一定不含Al3+和K+,選項A錯誤;B. 原溶液中含有的離子只有:NO3- 、Cl- 、SO42-、NH4+、Fe3+,選項B錯誤;C. 原溶液中c(NO3-)=0.2 mol·L-1,c(Fe3+)=0.2 mol·L-1,選項C正確;D. 在原溶液中加入足量的鐵粉,發(fā)生反應:2Fe3++ Fe = 3Fe2+所得溶液中陽離子所帶正電荷數(shù)基本不變,選項D錯誤。答案選C。
=0.02mol。n(+)=n(NH4+)+3n(Fe3+)=0.02mol+3×0.02mol=0.08mol,n(-)=2 n(SO42-)=2×0.02mol=0.04mol<0.08mol,故溶液中還有其他陰離子,且所含陰離子的物質的量相等,故n(-)=2 n(SO42-)+n(NO3-)+n(Cl-)=2×0.02mol+0.02mol+0.02mol=0.08mol,因此溶液中一定含有NO3- 、Cl-,一定不含Al3+和K+。故A.原溶液中一定不含Al3+和K+,選項A錯誤;B. 原溶液中含有的離子只有:NO3- 、Cl- 、SO42-、NH4+、Fe3+,選項B錯誤;C. 原溶液中c(NO3-)=0.2 mol·L-1,c(Fe3+)=0.2 mol·L-1,選項C正確;D. 在原溶液中加入足量的鐵粉,發(fā)生反應:2Fe3++ Fe = 3Fe2+所得溶液中陽離子所帶正電荷數(shù)基本不變,選項D錯誤。答案選C。
【題型】單選題
【結束】
8
【題目】根據(jù)要求回答下列問題:
(1)已知恒溫、恒容條件下發(fā)生反應:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
①下列圖像說明該反應進行到t1時刻未達平衡狀態(tài)的是________(填選項字母)。
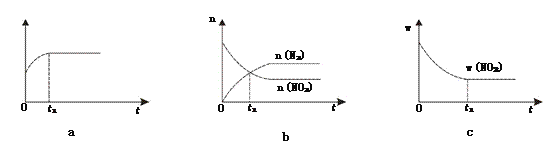
②1 molNO2和足量C發(fā)生反應,測得平衡時NO2和CO2的物質的量濃度與平衡總壓的關系如圖所示。
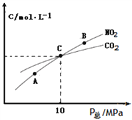
圖中A、B、C三點NO2的轉化率最高的是_____,該反應的平衡常數(shù)Kp=_______(Kp是用平衡分壓代替平衡濃度的常數(shù),分壓=總壓×物質的量分數(shù))。
(2)已知:弱電解質的電離平衡常數(shù)為
物質 | H2CO | H2S | HNO2 |
電離平衡常數(shù) (25℃) | Ka1=4.2×10-7 Ka2=5.61×10-11 | Ka1=1.3×10-7 Ka2=7.1×10-15 | Ka=5.1×10-4 |
①含有1L 2mol·L-1碳酸鈉的溶液中加入1L 1mol·L-1的HNO2后,則溶液中CO32-、HCO3-和NO2-的離子濃度由大到小是_______。
②25℃時,在0.10 mol·L-1H2S溶液中,通人HCl氣體或加入NaOH固體,溶液pH與c(S2-)關系如圖所示(忽略溶液體積的變化、H2S的揮發(fā))。pH=13時,溶液中的c(H2S)+c(HS-)=____mol·L-1;
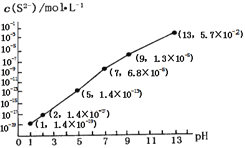
③向10.00mL0.10 mol·L-1的氫硫酸中滴加10.00mL0.1 mol·L-1NaOH溶液,溶液呈_____性,其定量依據(jù)是______________________ .
(3)已知:①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
②CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) △H= -189.2kJmol-1
CaS(s)+4CO2(g) △H= -189.2kJmol-1
則:CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H=_______kJmol-1.
CaS(s)+3CO2(g) △H=_______kJmol-1.
【答案】 b A 2MPa c(HCO3- )>c(NO2- )>c(CO32-) 0.043或4.3×10-2 堿性 此時恰好生成NaHS溶液,Ka(HS-)=7.1×10-15<Kh(HS-)=KW/ Ka1(H2S)=10-14/(1.3×10-7)=7.7×10-8,即水解程度遠大于電離程度,所以呈堿性 -399.7
【解析】(1)①根據(jù)“變量不變達平衡”判斷,a、反應中碳是固體,恒容條件下的混合物的密度是變量,t1時刻密度不變說明反應已達平衡狀態(tài);b、t1時刻是n(N2)=n(NO2),是反應物量的特殊比例,且后面量的變化可看到各反應物的量還沒恒定,還沒達到平衡狀態(tài);c、t1時刻二氧化氮的質量分數(shù)不變,則反應物各物質的質量分數(shù)也應不變,反應達到平衡狀態(tài);答案選b;②A、B、C三點中達到平衡狀態(tài)后A點NO2濃度最小,所以NO2的轉化率最高;③由焦炭還原NO2的反應為:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒溫條件下,1 mol NO2和足量C發(fā)生反應在C點時,NO2和CO2的物質的量濃度相等,可知此時反應體系中n(NO2)=0.5mol,n(N2)=0.25mol,n(CO2)=0.5mol,則三種物質的分壓分別為:P(NO2)= P(CO2)=10MPa×
N2(g)+2CO2(g),在恒溫條件下,1 mol NO2和足量C發(fā)生反應在C點時,NO2和CO2的物質的量濃度相等,可知此時反應體系中n(NO2)=0.5mol,n(N2)=0.25mol,n(CO2)=0.5mol,則三種物質的分壓分別為:P(NO2)= P(CO2)=10MPa×![]() =4MPa,P(N2)=2MPa,C點時該反應的壓強平衡常數(shù)Kp(C)=
=4MPa,P(N2)=2MPa,C點時該反應的壓強平衡常數(shù)Kp(C)= 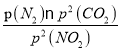 =
=![]() =2MPa;(2)①由亞硝酸的電離平衡常數(shù)Ka=5.1×10-4,H2CO的Ka1=4.2×10-7、Ka2=5.61×10-11可判斷亞硝酸的酸性強于碳酸,因此向含有2mol碳酸鈉的溶液中加入1mol的HNO2后生成1mol碳酸氫鈉、1mol亞硝酸鈉,另外還剩余1mol碳酸鈉,水解程度大小順序為CO32->NO2-,水解生成HCO3-,所以溶液中CO32-、HCO3-和NO2-離子的濃度大小關系為c(HCO3- )>c(NO2- )>c(CO32-);②根據(jù)物料守恒有c(H2S)+c(HS-)+c(S2-)=0.10 mol·L-1,而由圖可知pH=13時,c(S2-)=5.7×10-2 mol·L-1,c(H2S)+c(HS-)=0.10 mol·L-1-c(S2-)=0.10 mol·L-1-5.7×10-2 mol·L-1= 4.3×10-2 mol·L-1;③向10.00mL0.10 mol·L-1的氫硫酸中滴加10.00mL0.1 mol·L-1NaOH溶液,溶液呈堿性,其定量依據(jù)是此時恰好生成NaHS溶液,Ka(HS-)=7.1×10-15<Kh(HS-)=KW/ Ka1(H2S)=10-14/(1.3×10-7)=7.7×10-8,即水解程度遠大于電離程度,所以呈堿性;(3)已知:①CaSO4(s)+CO(g)
=2MPa;(2)①由亞硝酸的電離平衡常數(shù)Ka=5.1×10-4,H2CO的Ka1=4.2×10-7、Ka2=5.61×10-11可判斷亞硝酸的酸性強于碳酸,因此向含有2mol碳酸鈉的溶液中加入1mol的HNO2后生成1mol碳酸氫鈉、1mol亞硝酸鈉,另外還剩余1mol碳酸鈉,水解程度大小順序為CO32->NO2-,水解生成HCO3-,所以溶液中CO32-、HCO3-和NO2-離子的濃度大小關系為c(HCO3- )>c(NO2- )>c(CO32-);②根據(jù)物料守恒有c(H2S)+c(HS-)+c(S2-)=0.10 mol·L-1,而由圖可知pH=13時,c(S2-)=5.7×10-2 mol·L-1,c(H2S)+c(HS-)=0.10 mol·L-1-c(S2-)=0.10 mol·L-1-5.7×10-2 mol·L-1= 4.3×10-2 mol·L-1;③向10.00mL0.10 mol·L-1的氫硫酸中滴加10.00mL0.1 mol·L-1NaOH溶液,溶液呈堿性,其定量依據(jù)是此時恰好生成NaHS溶液,Ka(HS-)=7.1×10-15<Kh(HS-)=KW/ Ka1(H2S)=10-14/(1.3×10-7)=7.7×10-8,即水解程度遠大于電離程度,所以呈堿性;(3)已知:①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H1= +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H1= +210.5kJmol-1
②CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) △H2= -189.2kJmol-1
CaS(s)+4CO2(g) △H2= -189.2kJmol-1
根據(jù)蓋斯定很,由②-①得反應:CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H=△H2-△H1= -189.2kJmol-1-210.5kJmol-1=-399.7kJmol-1。
CaS(s)+3CO2(g) △H=△H2-△H1= -189.2kJmol-1-210.5kJmol-1=-399.7kJmol-1。


科目:高中化學 來源: 題型:
【題目】已知:相關物質的溶度積常數(shù)見表:
物質 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10﹣20 | 2.6×10﹣39 | 1.7×10﹣7 | 1.3×10﹣12 |
現(xiàn)有某酸性CuCl2溶液中含有少量的FeCl2 , 為得到純凈的CuCl22H2O晶體,按如圖步驟進行提純:
(1)最適合作氧化劑X的是(填字母),加入X的目的是 . A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物質Y是(填化學式),調至溶液pH=4,使溶液中的Fe3+轉化為Fe(OH)3沉淀,此時溶液中的c(Fe3+)= . 過濾后,將所得濾液低溫蒸發(fā)、濃縮結晶,可得到CuCl22H2O晶體.
(2)某學習小組用“間接碘量法”測定含有CuCl22H2O晶體的試樣(不含能與I﹣發(fā)生反應的氧化性雜質)的純度,過程如下:取0.36g試樣溶于水,加入過量KI固體,充分反應,生成白色沉淀.用0.1000molL﹣1Na2S2O3標準溶液滴定,到達滴定終點時,消耗Na2S2O3標準溶液20.00mL.(I2+2S2O32﹣═S4O62﹣+2I﹣)①可選用作滴定指示劑.②CuCl2溶液與KI反應的離子方程式為 .
③該試樣中CuCl22H2O的質量百分數(shù)為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學能和電能的相互轉化,是能量轉化的重要方式之一,如圖兩個實驗裝置是實現(xiàn)化學能和電能相互轉化的裝置.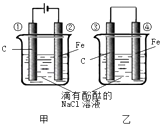
(1)把化學能轉化為電能的裝置是(填“甲”或“乙”)
(2)④電極上的電極反應式為
(3)①電極上的電極反應式 , 檢驗該電極反應產物的方法是
(4)甲、乙兩裝置電極附近的溶液首先變紅的電極分別是、(填序號)
(5)寫出裝置甲的反應總方程式 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學研究發(fā)現(xiàn)鉑的兩種化合物(短線表示化學健)有不同的特性,其中a具有抗癌作用,而b沒有;則下列正確的說法是( ) 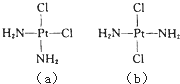
A.a、b分子中,Pt原子與2個Cl原子,2個N原子間形成的結構與CH2Cl2相似
B.a在水中的溶解度比b在水中的溶解度大
C.a、b互為同素異形體
D.a、b是同一物質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關物理量與其單位匹配正確的是( )
A.質量﹣﹣g
B.反應速率﹣﹣molL﹣1
C.摩爾質量﹣﹣gmol﹣1
D.氣體摩爾體積﹣﹣Lmol﹣1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據(jù)要求回答下列問題:
(1)已知恒溫、恒容條件下發(fā)生反應:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
①下列圖像說明該反應進行到t1時刻未達平衡狀態(tài)的是________(填選項字母)。
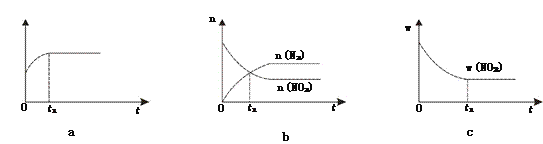
②1 molNO2和足量C發(fā)生反應,測得平衡時NO2和CO2的物質的量濃度與平衡總壓的關系如圖所示。

圖中A、B、C三點NO2的轉化率最高的是_____,該反應的平衡常數(shù)Kp=_______(Kp是用平衡分壓代替平衡濃度的常數(shù),分壓=總壓×物質的量分數(shù))。
(2)已知:弱電解質的電離平衡常數(shù)為
物質 | H2CO | H2S | HNO2 |
電離平衡常數(shù) (25℃) | Ka1=4.2×10-7 Ka2=5.61×10-11 | Ka1=1.3×10-7 Ka2=7.1×10-15 | Ka=5.1×10-4 |
①含有1L 2mol·L-1碳酸鈉的溶液中加入1L 1mol·L-1的HNO2后,則溶液中CO32-、HCO3-和NO2-的離子濃度由大到小是_______。
②25℃時,在0.10 mol·L-1H2S溶液中,通人HCl氣體或加入NaOH固體,溶液pH與c(S2-)關系如圖所示(忽略溶液體積的變化、H2S的揮發(fā))。pH=13時,溶液中的c(H2S)+c(HS-)=____mol·L-1;
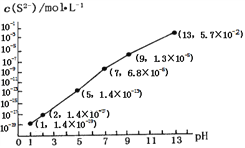
③向10.00mL0.10 mol·L-1的氫硫酸中滴加10.00mL0.1 mol·L-1NaOH溶液,溶液呈_____性,其定量依據(jù)是______________________ .
(3)已知:①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
②CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) △H= -189.2kJmol-1
CaS(s)+4CO2(g) △H= -189.2kJmol-1
則:CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H=_______kJmol-1.
CaS(s)+3CO2(g) △H=_______kJmol-1.
【答案】 b A 2MPa c(HCO3- )>c(NO2- )>c(CO32-) 0.043或4.3×10-2 堿性 此時恰好生成NaHS溶液,Ka(HS-)=7.1×10-15<Kh(HS-)=KW/ Ka1(H2S)=10-14/(1.3×10-7)=7.7×10-8,即水解程度遠大于電離程度,所以呈堿性 -399.7
【解析】(1)①根據(jù)“變量不變達平衡”判斷,a、反應中碳是固體,恒容條件下的混合物的密度是變量,t1時刻密度不變說明反應已達平衡狀態(tài);b、t1時刻是n(N2)=n(NO2),是反應物量的特殊比例,且后面量的變化可看到各反應物的量還沒恒定,還沒達到平衡狀態(tài);c、t1時刻二氧化氮的質量分數(shù)不變,則反應物各物質的質量分數(shù)也應不變,反應達到平衡狀態(tài);答案選b;②A、B、C三點中達到平衡狀態(tài)后A點NO2濃度最小,所以NO2的轉化率最高;③由焦炭還原NO2的反應為:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒溫條件下,1 mol NO2和足量C發(fā)生反應在C點時,NO2和CO2的物質的量濃度相等,可知此時反應體系中n(NO2)=0.5mol,n(N2)=0.25mol,n(CO2)=0.5mol,則三種物質的分壓分別為:P(NO2)= P(CO2)=10MPa×
N2(g)+2CO2(g),在恒溫條件下,1 mol NO2和足量C發(fā)生反應在C點時,NO2和CO2的物質的量濃度相等,可知此時反應體系中n(NO2)=0.5mol,n(N2)=0.25mol,n(CO2)=0.5mol,則三種物質的分壓分別為:P(NO2)= P(CO2)=10MPa×![]() =4MPa,P(N2)=2MPa,C點時該反應的壓強平衡常數(shù)Kp(C)=
=4MPa,P(N2)=2MPa,C點時該反應的壓強平衡常數(shù)Kp(C)= 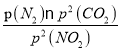 =
=![]() =2MPa;(2)①由亞硝酸的電離平衡常數(shù)Ka=5.1×10-4,H2CO的Ka1=4.2×10-7、Ka2=5.61×10-11可判斷亞硝酸的酸性強于碳酸,因此向含有2mol碳酸鈉的溶液中加入1mol的HNO2后生成1mol碳酸氫鈉、1mol亞硝酸鈉,另外還剩余1mol碳酸鈉,水解程度大小順序為CO32->NO2-,水解生成HCO3-,所以溶液中CO32-、HCO3-和NO2-離子的濃度大小關系為c(HCO3- )>c(NO2- )>c(CO32-);②根據(jù)物料守恒有c(H2S)+c(HS-)+c(S2-)=0.10 mol·L-1,而由圖可知pH=13時,c(S2-)=5.7×10-2 mol·L-1,c(H2S)+c(HS-)=0.10 mol·L-1-c(S2-)=0.10 mol·L-1-5.7×10-2 mol·L-1= 4.3×10-2 mol·L-1;③向10.00mL0.10 mol·L-1的氫硫酸中滴加10.00mL0.1 mol·L-1NaOH溶液,溶液呈堿性,其定量依據(jù)是此時恰好生成NaHS溶液,Ka(HS-)=7.1×10-15<Kh(HS-)=KW/ Ka1(H2S)=10-14/(1.3×10-7)=7.7×10-8,即水解程度遠大于電離程度,所以呈堿性;(3)已知:①CaSO4(s)+CO(g)
=2MPa;(2)①由亞硝酸的電離平衡常數(shù)Ka=5.1×10-4,H2CO的Ka1=4.2×10-7、Ka2=5.61×10-11可判斷亞硝酸的酸性強于碳酸,因此向含有2mol碳酸鈉的溶液中加入1mol的HNO2后生成1mol碳酸氫鈉、1mol亞硝酸鈉,另外還剩余1mol碳酸鈉,水解程度大小順序為CO32->NO2-,水解生成HCO3-,所以溶液中CO32-、HCO3-和NO2-離子的濃度大小關系為c(HCO3- )>c(NO2- )>c(CO32-);②根據(jù)物料守恒有c(H2S)+c(HS-)+c(S2-)=0.10 mol·L-1,而由圖可知pH=13時,c(S2-)=5.7×10-2 mol·L-1,c(H2S)+c(HS-)=0.10 mol·L-1-c(S2-)=0.10 mol·L-1-5.7×10-2 mol·L-1= 4.3×10-2 mol·L-1;③向10.00mL0.10 mol·L-1的氫硫酸中滴加10.00mL0.1 mol·L-1NaOH溶液,溶液呈堿性,其定量依據(jù)是此時恰好生成NaHS溶液,Ka(HS-)=7.1×10-15<Kh(HS-)=KW/ Ka1(H2S)=10-14/(1.3×10-7)=7.7×10-8,即水解程度遠大于電離程度,所以呈堿性;(3)已知:①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H1= +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H1= +210.5kJmol-1
②CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) △H2= -189.2kJmol-1
CaS(s)+4CO2(g) △H2= -189.2kJmol-1
根據(jù)蓋斯定很,由②-①得反應:CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H=△H2-△H1= -189.2kJmol-1-210.5kJmol-1=-399.7kJmol-1。
CaS(s)+3CO2(g) △H=△H2-△H1= -189.2kJmol-1-210.5kJmol-1=-399.7kJmol-1。
點睛:本題主要是考查了弱電解質的電離、弱電解質的水解以及反應熱計算等。該題考查的知識點較多,側重考查學生對知識的遷移應用,注意信息的理解和綜合應用。難點是電離平衡常數(shù)以及鹽類水解的應用。解答時要明確電離平衡常數(shù)與化學平衡常數(shù)一樣,平衡常數(shù)越大弱電解質的電離程度越大,從而可以判斷相應酸堿的相對強弱,進而可以判斷相應的鹽的水解程度大小。(2)②中的計算要注意靈活應用物料守恒,同時要注意結合圖像進行分析與計算。
【題型】綜合題
【結束】
9
【題目】三氯化硼是重要的化工原料。可用于制取乙硼烷(B2H6),也可作有機合成的催化劑。
【查閱資料】①BCl3的沸點為12.5℃,熔點為-107.3℃;
②2B+6HCl![]() BCl3+3H2 ,硼也能與強堿反應。
BCl3+3H2 ,硼也能與強堿反應。
某研究性學習小組用如下所示裝置制備三氯化硼。回答下列問題:
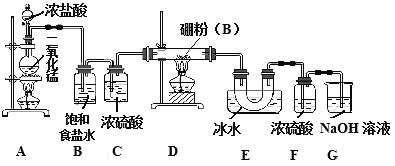
(1)A裝置中反應的離子方程式_______________________。
(2)B裝置的作用是____________;如果拆去B裝置,可能的后果是__________________。
(3)D裝置中發(fā)生反應的化學方程式_____________。
(4)G裝置的作用是_____;為使實驗裝置簡便,可用一個裝置代替F和G裝置。該裝置所用儀器是___,所裝試劑是____。
(5)A、D兩處加熱的先后順序是_____________,其理由是_______________。
(6)檢驗制得的產品中是含有硼粉的實驗操作是________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】當前我國環(huán)保亟待解決的“白色污染”,通常所指的是( )
A.冶煉廠的白色煙塵
B.石灰窯的白色粉塵
C.白色建筑廢料
D.聚乙烯等塑料垃圾
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列溶液中的微粒濃度關系正確的是( )
A.新制氯水中加入固體NaOH:c(Na+)=c(Cl﹣)+c(ClO﹣)+c(OH﹣)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO ![]() )>c(CO
)>c(CO ![]() )>c(H2CO3)
)>c(H2CO3)
C.0.2mol?L﹣1 CH3COOH溶液與0.1mol?L﹣1 NaOH溶液等體積混合:2c(H+)﹣2c(OH﹣)=c(CH3COO﹣)﹣c(CH3COOH)
D.pH=11的氨水與pH=3的鹽酸等體積混合:c(Cl﹣)=c(NH4+)>c(OH﹣)=c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.熱的濃HNO3能使藍色石蕊試紙先變紅后褪色
B.用HNO3和Na2S反應可以制得H2S氣體
C.濃硫酸使蔗糖炭化,體現(xiàn)濃硫酸的的吸水性
D.熱的濃硫酸可以用鐵制器皿貯存
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com