
在容積一定的密閉容器中,反應(yīng)2A B(g)+C(g)達(dá)到平衡后,升高溫度容器內(nèi)氣體的密度增大,則下列敘述正確的是 ( )
B(g)+C(g)達(dá)到平衡后,升高溫度容器內(nèi)氣體的密度增大,則下列敘述正確的是 ( )
| A.正反應(yīng)是放熱反應(yīng),且A是氣態(tài) |
| B.正反應(yīng)是吸熱反應(yīng),且A不是氣態(tài) |
| C.其他條件不變,加入少量A,該平衡向正反應(yīng)方向移動 |
| D.改變壓強(qiáng)對該平衡的移動無影響 |
科目:高中化學(xué) 來源: 題型:單選題
已知N2(g)+3H2(g) 2NH3(g) △H="—92.4" KJ/mol。在一恒溫恒壓的密閉容器里充入2mol N2和8mol H2達(dá)到平衡時生成1 mol NH3。現(xiàn)在相同條件下的同一容器中充入x mol N2,y mol H2和2 mol NH3,達(dá)到平衡時,NH3的質(zhì)量分?jǐn)?shù)與原來相同,且放出熱量46.2KJ。則x、y的值分別為( )
2NH3(g) △H="—92.4" KJ/mol。在一恒溫恒壓的密閉容器里充入2mol N2和8mol H2達(dá)到平衡時生成1 mol NH3。現(xiàn)在相同條件下的同一容器中充入x mol N2,y mol H2和2 mol NH3,達(dá)到平衡時,NH3的質(zhì)量分?jǐn)?shù)與原來相同,且放出熱量46.2KJ。則x、y的值分別為( )
| A.1.5, 6.5 | B.2, 8 | C.5, 21 | D.3, 13 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:單選題
對于A2 + 3B2  2C的反應(yīng)來說,以下化學(xué)反應(yīng)速率的表示中,反應(yīng)速率最快的是
2C的反應(yīng)來說,以下化學(xué)反應(yīng)速率的表示中,反應(yīng)速率最快的是
A.v (B2) =" 0.8mol/" (L?s) B.v (A2) =" 0.4mol/" (L?s)
C.v (C) =" 0.6mol/" (L?s) D.v (B2) =" 4.2mol/" (L?min)
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:單選題
對于反應(yīng)2SO2+O2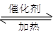 2SO3,下列判斷正確的是
2SO3,下列判斷正確的是
| A.2 mol SO2和足量的O2反應(yīng),一定生成2mol SO3 |
| B.平衡時SO2、O2、SO3的分子數(shù)之比為2∶1∶2 |
| C.平衡時SO2的消耗速率等于O2的生成速率的2倍 |
| D.平衡時SO2的濃度為O2濃度的2倍 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:單選題
可逆反應(yīng)A(g)+ 4B(g) C(g)+ D(g),在四種不同情況下的反應(yīng)速率如下,其中反應(yīng)進(jìn)行得最快的是( )
C(g)+ D(g),在四種不同情況下的反應(yīng)速率如下,其中反應(yīng)進(jìn)行得最快的是( )
| A.vA==0.15mol/(L·min) | B.vB="=0.6" mol/(L·min) |
| C.vC="=0.4" mol/(L·min) | D.vD="=0.01" mol/(L·s) |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:單選題
由可逆反應(yīng)繪出圖像如圖,縱坐標(biāo)為生成物在平衡混合物中的百分含量,下列對該反應(yīng)的判斷正確的是 ( )
| A.反應(yīng)物中一定有氣體 | B.生成物中一定有氣體 |
| C.正反應(yīng)一定是放熱反應(yīng) | D.正反應(yīng)一定是吸熱反應(yīng) |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:單選題
(2分)下圖表示在密閉容器中反應(yīng):CO2(g)+C(s) 2CO(g)△H>0達(dá)到平衡時,由于條件改變而引起反應(yīng)速度和化學(xué)平衡的變化情況,ab過程中改變的條件可能是 ;bc過程中改變的條件可能是 ;
2CO(g)△H>0達(dá)到平衡時,由于條件改變而引起反應(yīng)速度和化學(xué)平衡的變化情況,ab過程中改變的條件可能是 ;bc過程中改變的條件可能是 ;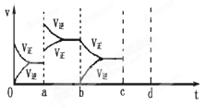
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:單選題
下列條件下化學(xué)反應(yīng)速率最大的是( )
| A.20℃0.1mol·L-1的鹽酸溶液20 mL與0.5 g塊狀碳酸鈣反應(yīng) |
| B.10℃ 0.1mol·L-1的鹽酸溶液20 mL與1 g塊狀碳酸鈣反應(yīng) |
| C.10℃ 0.2mol·L-1的鹽酸溶液10mL與0.5g粉狀碳酸鈣反應(yīng) |
| D.20℃ 0.2mol·L-1的鹽酸溶液10mL與0.5g粉狀碳酸鈣反應(yīng) |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:單選題
反應(yīng)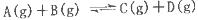 過程中的能量變化如圖所示,下列說法錯誤的是
過程中的能量變化如圖所示,下列說法錯誤的是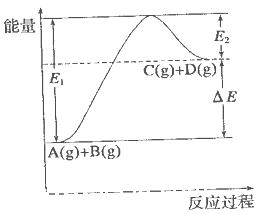
| A.該反應(yīng)是吸熱反應(yīng) |
| B.加入催化劑后,反應(yīng)加快,A的轉(zhuǎn)化率不變 |
| C.反應(yīng)物的總鍵能小于生成物的總鍵能 |
| D.反應(yīng)達(dá)到平衡時,升高溫度,A的轉(zhuǎn)化率增大 |
查看答案和解析>>
國際學(xué)校優(yōu)選 - 練習(xí)冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com