
下列說法正確的是( )。
A.反應A(g)  2B(g) ΔH,若正反應的活化能為Ea kJ·mol-1,逆反應的活化能為Eb kJ·mol-1,則ΔH=(Ea-Eb) kJ·mol-1 2B(g) ΔH,若正反應的活化能為Ea kJ·mol-1,逆反應的活化能為Eb kJ·mol-1,則ΔH=(Ea-Eb) kJ·mol-1 |
| B.標準狀況下,向0.1 mol·L-1的氨水中加入少量氯化銨晶體,若混合溶液pH=7,則c(NH4+)=c(Cl-) |
| C.足量的鋅銅合金與100 mL pH=1稀硫酸反應,反應3 s時測得pH=2,假設反應前后溶液的體積保持不變,則3 s內產生氫氣的平均速率是33.6 mL·s-1 |
D.將濃度為0.1 mol·L-1 HF溶液加水不斷稀釋過程中,電離平衡常數Ka(HF)保持不變,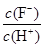 始終保持增大 始終保持增大 |
科目:高中化學 來源: 題型:單選題
已知下列熱化學方程式:
①C(s)+O2(g)==CO2(g)△H= —393.5kJ/mol
②CO(g)+ 1/2 O2(g)="=" CO2(g)△H= —283.0kJ/mol
③2Fe(s)+3CO(g)==Fe2O3(s)+3C(s)△H= —489.0kJ/mol
則4Fe(s)+3O2(g)==2Fe2O3(s)的反應熱ΔH為( )
| A.-1641.0kJ/mol | B.+3081kJ/mol |
| C.+663.5kJ/mol | D.-2507.0kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
甲醇質子交換膜燃料電池中將甲醇蒸氣轉化為氫氣的兩種反應原理是
① CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
② CH3OH(g)+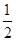 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
則下列說法正確的是( )
| A.CH3OH的燃燒熱為192.9 kJ/mol |
B.反應①中的能量變化如圖所示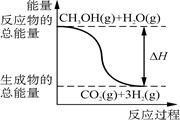 |
| C.CH3OH轉變成H2的過程一定要吸收能量 |
D.根據②推知反應:CH3OH(l)+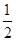 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
根據碘與氫氣反應的熱化學方程式
(ⅰ)I2(g)+H2(g)  2HI(g) ΔH=-9.48 kJ·mol-1
2HI(g) ΔH=-9.48 kJ·mol-1
(ⅱ)I2(s)+H2(g)  2HI(g) ΔH=+26.48 kJ·mol-1
2HI(g) ΔH=+26.48 kJ·mol-1
下列判斷正確的是( )
| A.1 mol I2(s)中通入2 g H2(g),反應吸熱26.48 kJ |
| B.1 mol固態碘與1 mol氣態碘所含的能量相差17.00 kJ |
| C.反應(ⅱ)的反應物總能量比反應(ⅰ)的反應物總能量低 |
| D.反應(ⅰ)放出的熱量多,所以產物的能量低,比反應(ⅱ)的產物更穩定 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
有關熱化學方程式書寫與對應表述均正確的是 ( )。
| A.稀醋酸與0.1 mol·L-1 NaOH溶液反應:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1 |
| B.密閉容器中,9.6 g硫粉與11.2 g鐵粉混合加熱生成硫化亞鐵17.6 g時,放出19.12 kJ熱量,則Fe(s)+S(s)=FeS(s) ΔH=-95.6 kJ·mol-1 |
| C.氫氣的燃燒熱為285.5 kJ·mol-1,則水電解的熱化學方程式為2H2O(l)=2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1 |
| D.已知2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1,則可知C的燃燒熱為110.5 kJ·mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
根據以下3個熱化學方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH=-a kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(l) ΔH=-b kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(g) ΔH=-c kJ·mol-1(a、b、c均為正數)
對a、b、c三者大小關系的判斷正確的是( )
| A.a>b>c | B.a>c>b | C.c>b>a | D.b>a>c |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下圖是N2與H2反應生成NH3的過程中能量變化的曲線圖:
下列敘述正確的是( )。
| A.該反應的熱化學方程式為N2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ |
| B.b曲線是加入催化劑時的能量變化曲線 |
| C.加入催化劑,該化學反應的反應熱減小 |
| D.在溫度、體積一定的條件下,通入1 mol N2和3 mol H2反應后放出的熱量為Q1 kJ,若通入2 mol N2和6 mol H2反應后放出的熱量為Q2 kJ,則184>Q2>2Q1 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知反應:①101 kPa時,2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)
ΔH=-57.3 kJ/mol下列結論正確的是( )
| A.碳的燃燒熱的數值大于110.5 kJ/mol |
| B.①的反應熱ΔH為221 kJ/mol |
| C.濃硫酸與稀NaOH溶液反應的中和熱為-57.3 kJ/mol |
| D.稀醋酸與稀NaOH溶液反應生成1 mol水,放出57.3 kJ熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列關于化學反應的描述中正確的是 ( )。
| A.需要加熱才能發生的反應一定是吸熱反應 |
| B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,則含40.0 g NaOH的稀溶液與稀醋酸完全中和,也放出57.3 kJ的熱量 |
| C.CO(g)的燃燒熱是283.0 kJ·mol-1,則表示CO(g)的燃燒熱的熱化學方程式為2CO(g)+O2(g)=2CO2(g) ΔH=-283.0 kJ·mol-1 |
| D.已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,則b>a |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com