
【題目】四氯化鈦是生產金屬鈦及其化合物的重要中間體。某校化學課外活動小組準備利用如圖裝置制備四氯化鈦(部分夾持儀器已略去)。
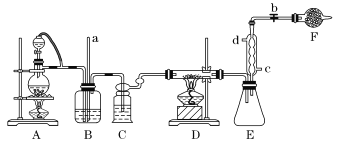
資料表明:室溫下,四氯化鈦為無色液體,熔點:-25℃,沸點:136.4℃。在空氣中發煙生成二氧化鈦固體。在650~850℃下,將氯氣通過二氧化鈦和炭粉的混合物可得到四氯化鈦和一種有毒氣體。回答下列問題:
(1)裝置A中加熱前應向燒瓶中加入___。
(2)實驗中B裝置的作用是___。
(3)寫出D裝置中物質制備的化學方程式___;寫出四氯化鈦在空氣中發煙的化學方程式__。
(4)E處球形冷凝管的冷卻水應從___(填“c”或“d”)口通入。
(5)F裝置中盛裝的物質是___。
(6)該實驗設計略有缺陷,請指出其不足之處:___。
【答案】沸石或碎瓷片 洗去Cl2中的HCl氣體;用作安全瓶(或用作平衡氣壓的安全裝置,或用作防堵塞的安全裝置) TiO2+2Cl2+2C![]() TiCl4+2CO TiCl4+2H2O=TiO2+4HCl↑ c 堿石灰 沒有對CO進行尾氣處理
TiCl4+2CO TiCl4+2H2O=TiO2+4HCl↑ c 堿石灰 沒有對CO進行尾氣處理
【解析】
在A裝置中制備氯氣,實驗室用二氧化錳跟濃鹽酸反應制取氯氣,通過裝有飽和食鹽水的B瓶和裝有濃硫酸的C瓶后得到干燥純凈的氯氣,氯氣通過裝置D中二氧化鈦和炭粉的混合物可得到四氯化鈦和一種有毒氣體,按照原子守恒與氣體性質,該氣體為CO,E裝置連接球形冷凝管冷凝,從c口入水,d口出水。F是球形干燥管,因為生成的氣體為酸性氧化物,所以要裝入堿性物質如堿石灰等。根據分析進行題目解答。
(1)圓底燒瓶中加入碎瓷片或沸石防止爆沸。
(2)濃鹽酸易揮發,B瓶中裝有飽和食鹽水用于洗去Cl2中的HCl氣體。且中間加入導管a用于和大氣相通,平衡裝置的氣壓,防止發生安全事故。
(3)裝置D中氯氣通過二氧化鈦和炭粉的混合物可得到四氯化鈦和CO,反應方程式為TiO2+2Cl2+2C![]() TiCl4+2CO,生成的四氯化鈦容易與空氣中的水發生反應導致發煙現象,反應方程式為:TiCl4+2H2O=TiO2+4HCl↑。
TiCl4+2CO,生成的四氯化鈦容易與空氣中的水發生反應導致發煙現象,反應方程式為:TiCl4+2H2O=TiO2+4HCl↑。
(4)E裝置為球形冷凝管,下口入水上口出水,所以冷卻水從c口通入。
(5)F是球形干燥管,反應生成的氣體為酸性氣體,所以要裝入如堿石灰等堿性干燥劑。
(6)CO不會被堿石灰等物質吸收,會通過F裝置排出到空氣中,但是CO是有毒氣體,需要尾氣處理裝置。


 培優三好生系列答案
培優三好生系列答案科目:高中化學 來源: 題型:
【題目】I.將少量飽和氯化鐵溶液滴入沸水中,繼續煮沸,可制得Fe(OH)3膠體,反應的方程式為:FeCl3 + 3H2O ![]() Fe(OH)3(膠體) + 3HCl
Fe(OH)3(膠體) + 3HCl
(1)當溶液呈________時,停止加熱,即制得Fe(OH)3膠體。
(2)氫氧化鐵膠體與氫氧化鐵沉淀的本質區別是____________________。
(3)下列敘述錯誤的是________。
A.霧屬于膠體,能產生丁達爾效應
B.從顏色上無法區別FeCl3溶液和Fe(OH)3膠體
C.明礬可以用于凈水,凈水原理和膠體有關
D.用鹽鹵點豆腐與膠體性質有關
Ⅱ.有A、B、C、D四種可溶性鹽,它們的陽離子分別是Ba2+、Ag+、Na+、Cu2+中的某一種,陰離子分別是NO3-、SO42-、Cl-、CO32-中的一種(離子在物質中不重復出現)。
①若把四種鹽分別溶于盛有蒸餾水的四支試管中,只有C鹽的溶液呈藍色;
②若向四支試管中分別加入鹽酸,B鹽的溶液有沉淀生成,D鹽的溶液有無色無味的氣體逸出。請回答下列問題:
(4)A的化學式為____________,B的化學式為____________。
(5)寫出D與足量CH3COOH溶液反應的離子方程式_____________________________。
(6)寫出A溶液中陰離子的檢驗方法______________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,在一個2L的密閉容器中,加入4molA和 2molB進行如下反應:3A(g)+2B(g)![]() 4C(s)+2D(g)。反應一段時間后達到平衡,測得生成1.6molC,則下列說法正確的是( )
4C(s)+2D(g)。反應一段時間后達到平衡,測得生成1.6molC,則下列說法正確的是( )
A.該反應的化學平衡常數表達式是 K=![]()
B.此時,B的平衡轉化率是40%
C.增大該體系的壓強,平衡向右移動,化學平衡常數增大
D.增加 B,平衡向右移動,B的平衡轉化率增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碘化鉀是一種無色晶體,易溶于水。實驗室制備KI晶體的步驟如下:
Ⅰ.在如下圖所示的三頸燒瓶中加入研細的I2和一定量的30%KOH溶液,攪拌(已知:I2與KOH反應產物之一是KIO3);
Ⅱ.碘完全反應后,打開分液漏斗中的活塞、彈簧夾1、2,向裝置C中通入足量的H2S;
Ⅲ.反應結束后,向裝置C中加入稀H2SO4酸化,水浴加熱;
Ⅳ.冷卻,過濾得KI粗溶液。
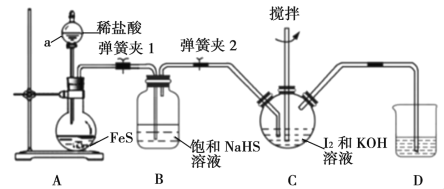
(1)儀器a的名稱是__________,步驟Ⅰ中控制KOH溶液過量的目的是______________。
(2)裝置B的作用是_____________,裝置D中盛放的溶液是________________。
(3)裝置C中H2S和KIO3反應的離子方程式為_______________________。
(4)步驟Ⅲ中水浴加熱的目的是除去_________________________(填化學式)。
(5)由步驟Ⅳ所得的KI粗溶液中含有少量K2SO4,需進行提純,提純流程如下:
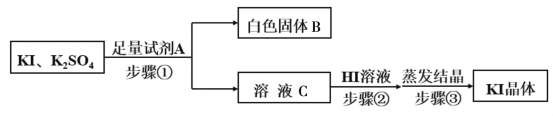
①已知白色固體B是混合物,試劑A為__________,為除去溶液C中的雜質,步驟②中調節溶液為弱酸性,則加入HI溶液后產生的現象是___________________。
②為測定最后所得KI晶體的純度,取a g晶體配制100mL溶液,取出25mL溶液,滴入足量稀的酸性K2Cr2O7溶液,充分反應后,滴加幾滴淀粉溶液為指示劑,用b mol·L-1的Na2S2O3溶液進行滴定,消耗Na2S2O3溶液VmL。
滴定過程中涉及的反應為:![]() ,
,![]() 則滴定終點時的現象為________________________,晶體的純度為_______________________(列出計算式)。
則滴定終點時的現象為________________________,晶體的純度為_______________________(列出計算式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家用氮化鎵(GaN)材料與銅作電極組裝如圖所示的人工光合系統,成功地實現了以CO2和H2O合成CH4。下列說法不正確的是( )
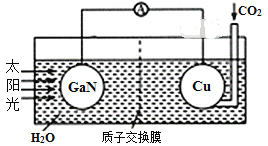
A.電子由GaN沿著導線流向Cu
B.電解液中H+從質子交換膜右側向左側遷移
C.GaN表面發生氧化反應,有O2產生
D.Cu表面電極反應式:CO2+8e-+8H+=CH4+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知NaHISO4溶于水時電離出Na+、H+、SO42-,某同學欲探究其化學性質,稱取了12.0g NaHSO4,固體配成100mL溶液,做了如下實驗:
①取20 mL該溶液加入足量Zn粒有大量氣體生成;
②取20 mL該溶液加入Fe2O3后溶液變黃色;
③取20 mL該溶液加入BaCl2溶液后有大量白色沉淀產生。
請回答下列問題:
(1)該實驗所配置的NaHSO4溶液物質的量濃度為__________。
(2)請用離子方程式解釋①中的實驗現象___________,該實驗過程中產生的氣體體積為__________(請按標準狀況下計算)。
(3)請用離子方程式解釋②中的實驗現象_________________。
(4)請用離子方程式解釋③中的實驗現象__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在可逆反應:2A(g)+3B(g)![]() xC(g)+D(g)中,已知:起始濃度A為5mol/L,B為3mol/L,C的反應速率為0.5mol/(L·min),2min后,測得D的濃度為0.5mol/L。則關于此反應的下列說法正確的是( )
xC(g)+D(g)中,已知:起始濃度A為5mol/L,B為3mol/L,C的反應速率為0.5mol/(L·min),2min后,測得D的濃度為0.5mol/L。則關于此反應的下列說法正確的是( )
A. 2min末時A和B的濃度之比為5:3
B. x=1
C. 2min末時B的濃度為1.5mol/L
D. 2min末時A的消耗濃度為0.5mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列操作對應的現象不符合事實的是
A. 將灼燒至黑色的銅絲插入無水乙醇,銅絲變成紅色
將灼燒至黑色的銅絲插入無水乙醇,銅絲變成紅色
B. 用激光筆照射Fe(OH)3膠體,產生丁達爾效應
用激光筆照射Fe(OH)3膠體,產生丁達爾效應
C. 將濕潤的有色布條放入盛有干燥氯氣的瓶中,布條不褪色
將濕潤的有色布條放入盛有干燥氯氣的瓶中,布條不褪色
D. 將滴管中的濃鹽酸加入碳酸氫鈉溶液,氣球體積由小變大
將滴管中的濃鹽酸加入碳酸氫鈉溶液,氣球體積由小變大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用密度為1.25 gmL﹣1、質量分數為36.5%的濃鹽酸配制240 mL 0.1 molL﹣1的鹽酸,請回答下列問題:
(1)濃鹽酸的物質的量濃度為________________________。
(2)配制240 mL 0.1 molL﹣1的鹽酸
應量取濃鹽酸體積/mL | 應選用容量瓶的規格/mL |
__________ | __________ |
(3)配制時,其正確的操作順序是(用字母表示,每個字母只能用一次)__________。
A.用30 mL水洗滌燒杯內壁和玻璃棒23次,洗滌液均注入容量瓶,振蕩
B.用量筒淮確量取所需的濃鹽酸的體積,倒入燒杯中,再加入少量水(約30 mL),用玻璃棒慢慢攪動,使其混合均勻
C.將已冷卻的鹽酸沿玻璃棒注入容量瓶中
D.將容量瓶蓋緊,振蕩,搖勻
E.改用膠頭滴管加水,使溶液凹液面恰好與刻度線相切
F.繼續往容量瓶內小心加水,直到液面接近刻度線12 cm處
(4)若實驗中遇到下列情況,對配制鹽酸的物質的量濃度有何影響(填“偏高”“偏低”或“不變”)
①用于稀釋鹽酸的燒杯未洗滌__________________________________________;
②容量瓶中原有少量蒸餾水____________________________________________;
③定容時俯視觀察液面________________________________________________。
(5)若實驗過程中出現如下情況如何處理?
①定容時加蒸餾水時超過了刻度________________________________________;
②向容量瓶中轉移溶液時不慎有溶液濺出________________________________;
③定容搖勻后發現液面下降____________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com