
【題目】下列物質屬于純凈物的是( )
A.冰水混合物
B.無污染的空氣
C.鹽酸
D.漂白粉
科目:高中化學 來源: 題型:
【題目】常溫時,體積均為50mL物質的量濃度均為0.10mol/L的HX、HY、HZ三種弱酸,分別用0.10mol/L的NaOH溶液滴定,滴定曲線如圖所示。下列有關說法錯誤的是
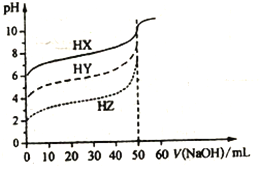
A. 濃度均為0.10mol/L時,酸的電離度:HX<HY<HZ
B. pH均為3.0的三種酸加水稀釋至pH均為6.5,加入水的量:HX>HY>HZ
C. 圖中當均滴入50mLNaOH溶液時,所得溶液中水的電離程度:HX>HY>HZ
D. 用NaOH溶液中和pH與體積均相等的三種酸時,消耗n(NaOH):HX<HY<HZ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據問題填空:
(1)2SO2(g)+O2(g)2SO3(g)反應過程的能雖變化如圖所示.己知1mol SO2(g)氧化為1mol SO3(g)的△H=﹣99kJ/mol. 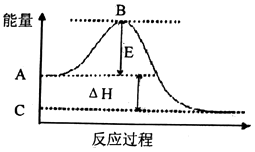
請回答下列問題:
①E的大小對該反應的反應熱(填“有”或“無”)影構.
②圖中△H=kJ/mol.
(2)由氫氣和氧氣反應生成1mol水蒸氣,放出241.8kJ熱量(25℃、101kPa下測得) ①寫出該反應的熱化學方程式: .
②若lmol水蒸氣轉化為液態水放熱45kJ,則反應H2(g)+ ![]() O2(g)=H2O(l)的△H=kJ/mol.
O2(g)=H2O(l)的△H=kJ/mol.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學反應A2+B2=2AB的能量變化如圖所示,則下列說法正確的是( ) 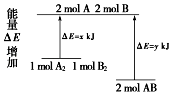
A.該反應的反應熱△H=x﹣y kJ/mol
B.斷裂1 mol A﹣A鍵和1 mol B﹣B鍵放出x kJ能量
C.2 mol AB的總能量高于1 mol A2和1 mol B2總能量
D.該反應是吸熱反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關晶體的敘述中,不正確的是( )
A.氯化鈉和氯化銫晶體中,陽離子的配位數均為6
B.金剛石為三維網狀結構,由碳原子以sp3雜化軌道形成共價鍵
C.金屬鈉的晶體采用體心立方堆積,每個晶胞含2個原子,配位數為8
D.干冰晶體中,每個CO2分子周圍緊鄰12個CO2分子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向含有5×10-3molHIO3 與少量淀粉的溶液中通入H2S,溶液變藍且有S析出,繼續通入H2S,溶液的藍色褪去,則在整個過程中( )
A. 共得到0.96g硫 B. 通入H2S的體積為336mL
C. 碘元素先被還原后被氧化 D. 轉移電子總數為3.0×10-2 NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】填寫下列空格。
(1)已知拆開1molH-H鍵、1molCl-Cl鍵、1molH-Cl鍵分別需要吸收的能量為436.4kJ、242.7kJ、431.8kJ。則由H2和Cl2反應生成1molHCl需要_____(填“放出”或“吸收”)____kJ的熱量。
(2)H2可以在Cl2中安靜地燃燒。甲、乙兩圖中,能表示該反應能量變化的是圖_____(填“甲”或“乙”)。

(3)已知:H2與Cl2在光照條件下會發生爆炸。同溫同壓下,反應H2(g)+Cl2(g)=2HCl(g)。在光照和點燃條件下的H_____(填“相等”或“不相等”)。
(4)硅、磷、硫、氯元素的氣態氫化物的形成條件和熱穩定性如下表所示:
元素符號 | Si | P | S | Cl |
單質與氫氣的反應 | 高溫下反應 | 磷蒸氣與氫氣能反應 | 加熱時反應 | 光照或點燃時發生爆炸而化合 |
氣態氫化物的熱穩定性 | 不穩定 | 不穩定 | 受熱分解 | 穩定 |
結合元素原子結構等知識,分析以上信息可得出的結論是:同周期非金屬元素,隨著元素核電荷數的遞增,____________________________________,因此,Si、P、S、Cl非金屬性依次增強。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國的礦產資源豐富。利用某冶煉廢渣(主要成分為二氧化硅和錫、銅、鉛、鐵的氧化物)回收錫、銅、鉛的工藝流程如下圖所示:

回答下列問題:
(1)電爐冶煉時,焦炭的作用是________(填“氧化劑”或“還原劑”),將焦炭粉碎的目的是__________。熔劑的主要成分是氟石(CaF2),高溫下能與SiO2反應生成兩種鈣鹽,其中之一為 CaSiF6,該反應的化學方程式為____________________________。![]()
(2)脫鐵后的溶液中含有少量的Sn2+,為減少錫的損失,可用錫、銅、鉛、鐵多元合金回收處理,反應的離子方程式為____________________________。
(3)已知SnO2不溶于稀硫酸。脫鐵后氧化焙燒的目的是__________________。
(4)電解CuSO4溶液時,陽極的電極反應式為___________________________。
(5)已知H2CO3的一、二級電離常數分別為K1、K2,PbSO4、PbCO3的溶度積常數分別為Ksp(PbSO4)、Ksp(PbCO3)。錫、鉛渣中的鉛主要以PbSO4存在,脫硫時發生的反應為:
PbSO4(s)+HCO3ˉ(aq) ![]() PbCO3(s)+H+(aq)+SO42-(aq),該反應的平衡常數K=___________(用上述已知常數表示)。脫硫后需過濾、洗滌再進入下一步工序,檢驗濾渣是否洗滌干凈的方法是_____________________________。
PbCO3(s)+H+(aq)+SO42-(aq),該反應的平衡常數K=___________(用上述已知常數表示)。脫硫后需過濾、洗滌再進入下一步工序,檢驗濾渣是否洗滌干凈的方法是_____________________________。
(6)若該冶煉廢渣中錫的質量分數為5%,30t廢渣制得精錫lt,則錫的回收率為_____________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com