
反應(yīng)aA(g)+bB(g) cC(g)(△H<0)在等容條件下進(jìn)行。改變其他反應(yīng)條件,在Ⅰ、Ⅱ、Ⅲ階段體系中各物質(zhì)濃度隨時(shí)間變化的曲線如下圖所示:
cC(g)(△H<0)在等容條件下進(jìn)行。改變其他反應(yīng)條件,在Ⅰ、Ⅱ、Ⅲ階段體系中各物質(zhì)濃度隨時(shí)間變化的曲線如下圖所示: 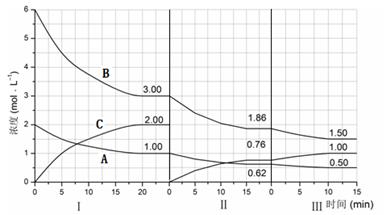
回答問(wèn)題:
(1)反應(yīng)的化學(xué)方程式中,a:b:c為 ;
(2)B的平衡轉(zhuǎn)化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最大的是 ,其值是 ;
(3)由第一次平衡到第二次平衡,平衡移動(dòng)的方向是 ,采取的措施是 ;
(4)比較第Ⅱ階段反應(yīng)溫度(T2)和第Ⅲ階段反應(yīng)溫度(T3)的高低:T2 T3 (填“<”、“>或“=”),判斷的理由是 ;
(5)達(dá)到第三次平衡后,將容器的體積擴(kuò)大一倍,假定10min后達(dá)到新的平衡,請(qǐng)?jiān)谙聢D中用曲線表示第IV階段體系中B物質(zhì)的濃度隨時(shí)間變化的趨勢(shì)(注:只須畫出B的濃度隨時(shí)間變化曲線)。
(1)1∶3∶2(2分)
(2)αⅠ(B)(2分) 50%(2分)
(3)向正反應(yīng)方向(2分) 從反應(yīng)體系中移出產(chǎn)物C(2分)
(4)>(2分) 此反應(yīng)為放熱反應(yīng),降低溫度,平衡向正反應(yīng)方向移動(dòng)(或降低溫度,反應(yīng)速率減慢)(2分)
(5)(2分)
解析試題分析:(1)由圖可知第Ⅰ階段,平衡時(shí)△c(A)=2mol·L-1-1mol·L-1=1mol·L-1,△c(B)=6mol·L-1-3mol·L-1=3mol·L-1,△c(C)=2mol·L-1,濃度變化量之比等于化學(xué)計(jì)量數(shù)之比,故a:b:c=1mol·L-1:3mol·L-1:2mol·L-1=1:3:2,答案為:1:3:2;
⑵B的平衡轉(zhuǎn)化率αⅠ(B)= ×100%=50%,αⅡ(B)=
×100%=50%,αⅡ(B)= ×100%=38%,αⅢ(B)=
×100%=38%,αⅢ(B)=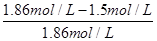 ×100%=19.4%,答案為:αⅠ(B);50%;
×100%=19.4%,答案為:αⅠ(B);50%;
⑶第Ⅱ階段C是從0開(kāi)始的,瞬間A、B濃度不變,因此可以確定第一次平衡后從體系中移出了C,即減少生成物濃度,平衡正向移動(dòng),答案為:平衡正向移動(dòng);從反應(yīng)體系中移出產(chǎn)物C;
⑷第Ⅲ階段的開(kāi)始與第Ⅱ階段的平衡各物質(zhì)的量均相等,根據(jù)A、B的量減少,C的量增加可判斷平衡是正向移動(dòng)的,根據(jù)平衡開(kāi)始時(shí)濃度確定此平衡移動(dòng)不可能是由濃度的變化引起的,另外題目所給條件容器的體積不變,則改變壓強(qiáng)也不可能,因此一定為溫度的影響,此反應(yīng)正向?yàn)榉艧岱磻?yīng),可以推測(cè)為降低溫度,另外結(jié)合A的速率在三個(gè)階段的情況,確定改變的條件一定為降低溫度,根據(jù)勒夏特列原理,平衡的移動(dòng)只能減弱改變,不能抵消改變,因此達(dá)到平衡后溫度一定比第Ⅱ階段平衡時(shí)的溫度低,答案為:>;此反應(yīng)為放熱反應(yīng),降低溫度,平衡向正反應(yīng)方向移動(dòng)。
⑸將容器的體積擴(kuò)大一倍后,容器內(nèi)壓強(qiáng)減小,平衡向逆反應(yīng)方向移動(dòng),A和B的物質(zhì)的量增大,C的物質(zhì)的量減小,但容器體積增大,則A、B、C的濃度都減小,
考點(diǎn):反應(yīng)速率的定量表示方法;化學(xué)平衡的計(jì)算



| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來(lái)源: 題型:填空題
在一定體積的密閉容器中,進(jìn)行化學(xué)反應(yīng)CO2 (g)+H2 (g) CO (g)+H2O (g),其化學(xué)平衡常數(shù)K和溫度t的關(guān)系如下表:
CO (g)+H2O (g),其化學(xué)平衡常數(shù)K和溫度t的關(guān)系如下表:
| t / ℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:填空題
I.設(shè)反應(yīng)①Fe(s)+CO2(g)  FeO(s)+CO(g)的平衡常數(shù)為K1。
FeO(s)+CO(g)的平衡常數(shù)為K1。
反應(yīng)②Fe(s)+H2O(g)  FeO(s)+H2(g)的平衡常數(shù)為K2,
FeO(s)+H2(g)的平衡常數(shù)為K2,
在不同溫度下,K1、K2的值如下:
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
 CO(g)+H2O(g),這是一個(gè) (填“吸”或“放”)熱反應(yīng),要使平衡③向右移動(dòng),可采取的措施有 (填序號(hào))。
CO(g)+H2O(g),這是一個(gè) (填“吸”或“放”)熱反應(yīng),要使平衡③向右移動(dòng),可采取的措施有 (填序號(hào))。 FeO(s)+CO(g)在溫度T1下進(jìn)行;Fe(s)+H2O(g)
FeO(s)+CO(g)在溫度T1下進(jìn)行;Fe(s)+H2O(g)  FeO(s)+H2(g)在溫度T2下進(jìn)行,已知T1>T2,且c(CO2)>c(H2O)(其他條件均相同),則兩者的反應(yīng)速率 (填序號(hào))
FeO(s)+H2(g)在溫度T2下進(jìn)行,已知T1>T2,且c(CO2)>c(H2O)(其他條件均相同),則兩者的反應(yīng)速率 (填序號(hào))
| 化學(xué)式 | 電離平衡常數(shù)(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:填空題
某些金屬及金屬氧化物對(duì)H2O2的分解反應(yīng)具有催化作用,請(qǐng)回答下列問(wèn)題:
(1)已知:2H2O2(aq) =" 2" H2O (l) + O2(g) 的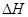 < 0, 則該反應(yīng)的逆反應(yīng)能否自發(fā)進(jìn)行? (填“能”或“不能”),判斷依據(jù)是 。
< 0, 則該反應(yīng)的逆反應(yīng)能否自發(fā)進(jìn)行? (填“能”或“不能”),判斷依據(jù)是 。
(2)某同學(xué)選用Ag、Pt、Cu、TiO2作為催化劑,在25℃ 時(shí),保持其它實(shí)驗(yàn)條件相同,測(cè)得生成的O2體積(V)。V與分解時(shí)間(t)的關(guān)系如圖所示(O2的體積已折算成標(biāo)準(zhǔn)狀況),則:在不同催化劑存在下,H2O2分解反應(yīng)的活化能大小順序是 Ea( ) > Ea( ) > Ea( ) > Ea( ) (括號(hào)內(nèi)填寫催化劑的化學(xué)式)金屬Pt 催化下,H2O2分解的反應(yīng)速率v(O2) = mol·s-1
(3)為研究溫度對(duì)H2O2分解速率的影響(不加催化劑),可將一定濃度和體積的H2O2置于密閉容器中,在某溫度下,經(jīng)過(guò)一定的時(shí)間t,測(cè)定生成O2的體積V。然后保持其它初始條件不變,改變溫度T,重復(fù)上述實(shí)驗(yàn)。獲得V(O2) ~ T關(guān)系曲線。下列趨勢(shì)圖最可能符合實(shí)測(cè)V(O2) ~ T關(guān)系曲線的是 ,原因是 。
| A. | B. | C. | D. (4)以Pt為電極電解H2O2也可產(chǎn)生氧氣,寫出H2O2水溶液電解過(guò)程中的電極反應(yīng)式(已知:H2O2的氧化性及還原性均比H2O強(qiáng)):陰極;陽(yáng)極 。 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:填空題
在體積為10L的容器中,通人一定量的CO和H2O,在850℃時(shí)發(fā)生如下反應(yīng):
CO(g)十H2O(g)  CO2(g)十H2 (g) △H<0 , CO和H2O濃度變化如下圖,
CO2(g)十H2 (g) △H<0 , CO和H2O濃度變化如下圖,
(1) 3min—4min之間反應(yīng)處于____狀態(tài)(填平衡、不平衡);
(2)要使反應(yīng)在8min后,平衡向逆方向移動(dòng),可采取的措施是__ ___,要使反應(yīng)在8min后,反應(yīng)速率降低,平衡向正方向移動(dòng),可采取的措施是________。(填a,b,c,d)
a.增加水蒸氣 b.降低溫度 c.使用催化劑 d.增加氫氣濃度
(3)求出850℃ 時(shí),該反應(yīng)的平衡常數(shù)和CO的平衡轉(zhuǎn)化率(寫出詳細(xì)計(jì)算過(guò)程)
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:填空題
碘及其化合物在人類活動(dòng)中占有重要地位。
(1)加碘食鹽中含有碘酸鉀(KIO3),工業(yè)上以電解法制備碘酸鉀,電解設(shè)備如圖所示。先將一定量的碘溶于過(guò)量氫氧化鉀溶液,發(fā)生反應(yīng):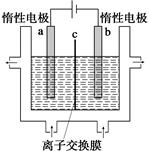
3I2+6KOH=5KI+KIO3+3H2O,再將該溶液加入 (陰極、陽(yáng)極)區(qū),另將氫氧化鉀溶液加入另外一個(gè)區(qū)。使用 (陰、陽(yáng))離子交換膜,在陽(yáng)極發(fā)生的電極反應(yīng)式: 。
(2)碘化氫不穩(wěn)定,分解反應(yīng)的熱化學(xué)方程式是2HI(g) I2(g)+H2(g) ΔH="+9.48" kJ·mol-1已知ΔS>0
I2(g)+H2(g) ΔH="+9.48" kJ·mol-1已知ΔS>0
①該反應(yīng)屬于( )
A.任何溫度均自發(fā) B.任何溫度均不自發(fā) C.高溫自發(fā) D.低溫自發(fā)
②一定條件下,反應(yīng)在一個(gè)帶有活塞的密閉容器中達(dá)到平衡,下列說(shuō)法中不正確的是( )
A.恒溫,縮小體積,平衡常數(shù)不變
B.恒溫,縮小體積,平衡不移動(dòng),顏色加深
C.恒容,升溫,正向反應(yīng)速率和逆向反應(yīng)速率均增大
D.恒容,在容器中若投入2mol HI,達(dá)到平衡時(shí)吸收9.48 kJ 的熱量
③一定溫度下,平衡常數(shù)K=1/4,在2L的容器中,加入4molHI發(fā)生反應(yīng)達(dá)到平衡,HI的轉(zhuǎn)化率 。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:填空題
在某密閉容器內(nèi)有正反應(yīng)為放熱的可逆反應(yīng),其中A、B為氣體,C為固體,若反應(yīng)開(kāi)始經(jīng) s后達(dá)平衡。如圖:
s后達(dá)平衡。如圖:
(1)該反應(yīng)的化學(xué)方程式為_(kāi)________________________
(2)反應(yīng)物的轉(zhuǎn)化率______________________
(3)要使反應(yīng)物的轉(zhuǎn)化率增加可能的原因是____________
A.增大了B或C的濃度 B.使用了催化劑
C.縮小體積,使體系壓強(qiáng)增大 D.升高了反應(yīng)溫度
(4)該反應(yīng)達(dá)到平衡后,向該容器中再充入0.5mol的He。若恒溫恒壓,,這時(shí)反應(yīng)速率 _________(填“加快”、“減慢”或“不變”),平衡_____________ (填“向正方向移動(dòng)”、“向逆方向移動(dòng)”、“不移動(dòng)”);若恒溫恒容時(shí),這時(shí)反應(yīng)速率_______(填“加快”、“減慢”或“不變”),反應(yīng)物的轉(zhuǎn)化率___________(填“加快”、“減慢”或“不變”)。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:填空題
在一容積為2 L的密閉容器中,加入0.2 mol的N2和0.6 mol的H2,在一定條件下發(fā)生反應(yīng):N2(g)+3H2(g)  2NH3(g) ΔH<0 。反應(yīng)中NH3的物質(zhì)的量濃度的變化情況如下圖所示,請(qǐng)回答下列問(wèn)題:
2NH3(g) ΔH<0 。反應(yīng)中NH3的物質(zhì)的量濃度的變化情況如下圖所示,請(qǐng)回答下列問(wèn)題:
(1)根據(jù)上圖,計(jì)算從反應(yīng)開(kāi)始到平衡時(shí),氫氣的平均反應(yīng)速率v(H2)為_(kāi)_____________。
(2)該反應(yīng)達(dá)到平衡時(shí)N2的轉(zhuǎn)化率_________________。
(3)反應(yīng)達(dá)到平衡后,第5分鐘末,保持其它條件不變,若改變反應(yīng)溫度,則NH3的物質(zhì)的量濃度不可能為_(kāi)___________。(填序號(hào))
a.0.20 mol·L-1 b.0.12 mol·L-1 c.0.10 mol·L-1 d.0.08 mol·L-1
(4)請(qǐng)寫出該反應(yīng)的平衡常數(shù)表達(dá)式_________,若該反應(yīng)在298K、398K時(shí)的化學(xué)平衡常數(shù)分別為K1、K2,則K1 K2(填“>”、“="”" 或 “<” )。
(5)在第5分鐘末將容器的體積縮小一半后,若在第8分鐘末達(dá)到新的平衡(此時(shí)NH3的濃度約為0.25 mol·L-1),請(qǐng)?jiān)谏蠄D中畫出第5分鐘末到此平衡時(shí)NH3濃度的變化曲線。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:填空題
碳單質(zhì)在工業(yè)上有多種用途。例如焦炭可用來(lái)制取水煤氣、冶煉金屬,活性炭可處理大氣污染物NO。
一定條件下,在2 L密閉容器中加入NO和活性炭(無(wú)雜質(zhì))反應(yīng)生成氣體A和B。當(dāng)溫度在T1℃時(shí),測(cè)得各物質(zhì)平衡時(shí)物質(zhì)的量如下表:
| | 活性炭 (mol) | NO (mol) | A (mol) | B (mol) |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| 平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
查看答案和解析>>
國(guó)際學(xué)校優(yōu)選 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com