
【題目】下列關系曲線不能正確反映其對應變化關系的是( )
A. 加熱KClO3和MnO2固體混合物
B. 向Ca(OH)2溶液中通入CO2至過量(碳酸鈣遇到溶有二氧化碳的水,能生成可溶性碳酸氫鈣) 
C. 向一定濃度的NaOH溶液中加水稀釋
D. 將等質量的Mg和Al分別與過量等濃度的鹽酸反應,則a為Mg,b為Al
 第三學期贏在暑假系列答案
第三學期贏在暑假系列答案 學練快車道快樂假期暑假作業新疆人民出版社系列答案
學練快車道快樂假期暑假作業新疆人民出版社系列答案科目:高中化學 來源: 題型:
【題目】烴A是重要的有機化工原料,由A經以下反應可制備一種有機玻璃:

已知以下信息:
①核磁共振氫譜表明D只有一種化學環境的氫;
②羰基化合物可發生以下反應:
 以是烴基,也可以是H原子)
以是烴基,也可以是H原子)
③E在甲醇、硫酸的作用下,發生酯化、脫水反應生成F。
回答下列問題:
(1)A的結構簡式為 _______________,A生成B的反應類型為______________。
(2)B生成C的化學方程式為___________________。
(3)D的結構簡式為_______________________,分子中最多有 _____個原子共平面。
(4)F的化學名稱為_______________________。
(5)F的同分異構體中能同時滿足下列條件的共有_______種(不含立體異構):
①能與飽和NaHCO3溶液反應產生氣體,
②能使Br2的四氯化碳溶液褪色。其中核磁共振氫譜顯示為4組峰,面積比為3 : 2 : 2 : 1的是_______(寫出其中一種的結構簡式)。
(6)聚乳酸 是一種生物可降解材料,參照上述信息設計由乙醇制備聚乳酸的合成路線 ___________
是一種生物可降解材料,參照上述信息設計由乙醇制備聚乳酸的合成路線 ___________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮氣氫氣合成氨過程中制氫氣的原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
(1)對于反應①,一定可以提高平衡體系中H2的百分含量,又能加快反應速率的措施是_______。
a.升高溫度 b.增大水蒸氣濃度 c.加入催化劑 d.降低壓強
(2)利用反應②,將CO進一步轉化,可提高H2的產量。若1 mol CO和H2的混合氣體(CO的體積分數為20%)與H2O反應,得到1.18 mol CO、CO2和H2的混合氣體,則CO的轉化率為________。
(3)圖(a)表示500 ℃、60.0 MPa條件下,原料氣投料比與平衡時NH3體積分數的關系。根據圖中a點數據計算N2的平衡體積分數:____________。
(4)依據溫度對合成氨反應的影響,在圖(b)坐標系中,畫出一定條件下的密閉容器內,從通入原料氣開始,隨溫度不斷升高,NH3物質的量變化的曲線示意圖________。


查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素周期律產生的根本原因就是隨著元素原子序數的遞增
A. 元素的相對原子質量逐漸增大
B. 核外電子排布呈周期性變化
C. 原子半徑呈周期性變化
D. 元素主要化合價呈周期性變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于pH變化的判斷正確的是( )
A.溫度升高,Na2CO3溶液pH減小B.溫度升高,純水pH增大
C.新制氯水經光照一段時間后,溶液pH減小D.氫氧化鈉溶液久置于空氣中,溶液pH變大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】阿斯巴甜(結構簡式如圖)具有清爽的甜味,甜度約為蔗糖的200倍。下列有關說法不正確的是

A. 分子式為:C14H18N2O5
B. 阿斯巴甜分子中有3種官能團
C. 阿斯巴甜在一定條件下既能與酸反應、又能與堿反應
D. 阿斯巴甜的水解產物中有兩種氨基酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四氯化鈦(TiCl4)是制取航天航空工業材料——鈦合金的重要原料。由鈦鐵礦(主要成分是FeTiO3)制備TiCl4,同時獲得副產品甲的工業生產流程如下:
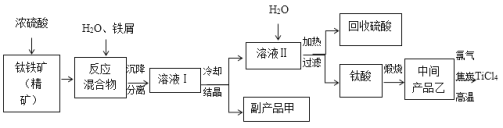
(1)已知酸浸反應FeTiO3+2H2SO4===FeSO4+TiOSO4+2H2O,則FeTiO3中鐵元素的化合價為___________。
(2)上述生產流程中加入鐵屑的目的是使Fe3+還原為Fe2+,且反應得到的溶液中含鈦元素的離子只有TiO2+,該過程發生的主要反應有:
①2Fe3++Fe===3Fe2+ ; ②2TiO2++Fe+4H+===2Ti3++Fe2++2H2O;③______________________________________。
(3)加熱TiOSO4溶液可制備TiO2·nH2O膠體,其反應的化學方程式為__________________。
(4)由TiO2·nH2O膠體制得固體TiO2·nH2O,再用酸清洗除去其中的Fe(OH)3雜質,還可制得鈦白粉。已知25℃時,Ksp[Fe(OH)3]=2.79×10-39,該溫度下反應Fe(OH)3+3H+![]() Fe3++3H2O的平衡常數K=___________________。
Fe3++3H2O的平衡常數K=___________________。
(5)可循環利用的物質是_________,副產品甲含結晶水,其化學式是_______________。
(6)依據下表信息,要精制含少量SiCl4雜質的TiCl4,可采用___________方法。
TiCl4 | SiCl4 | |
熔點/℃ | -25.0 | -68.8 |
沸點/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】放熱反應CO(g)+H2O(g)![]() CO2(g)+H2(g)在溫度t1時達到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常數為K1。升高反應體系的溫度至t2時,反應物的平衡濃度分別為c2(CO)和c2(H2O),平衡常數為K2,則( )
CO2(g)+H2(g)在溫度t1時達到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常數為K1。升高反應體系的溫度至t2時,反應物的平衡濃度分別為c2(CO)和c2(H2O),平衡常數為K2,則( )
A. K2和K1的單位均為mol·L-1
B. K2>K1
C. c2(CO)=c2(H2O)
D. c1(CO)>c2(CO)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為比較Fe3+和Cu2+對H2O2分解的催化效果,某化學研究小組的同學分別設計了如圖甲、乙所示的實驗.下列敘述中不正確的是( )
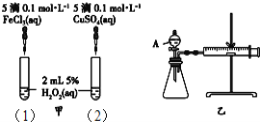
A. 實驗中H2O2分解的速率為(1)>(2)
B. 圖乙實驗可通過測定相同狀況下,產生的氣體體積與反應時間來比較反應速率
C. H2O2分解的熱化學方程式2H2O2(l)═2H2O(l)+O2(g)△H>0
D. 圖甲中(1)、(2)兩個實驗中H2O2分解的△H相同
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com