
【題目】設NA為阿伏加德羅常數的值,下列敘述正確的是
A. 1 mol·L-1的K2SO4溶液中含有2 mol K+
B. 1 mol Cl2完全溶于水轉移電子數為NA
C. 標準狀況下,2 mol Na2O2與44.8 L SO2完全反應,轉移的電子數目為4NA
D. 20 g T2O中含有NA個氧原子
 寒假學與練系列答案
寒假學與練系列答案科目:高中化學 來源: 題型:
【題目】下列說法或做法正確的是
A.液氯是混合物,氯水是純凈物
B.金屬鈉著火燃燒時,用泡沫滅火器滅火
C.鋁比鐵活潑,所以鋁比鐵更容易被腐蝕
D.CO2通入可溶性硅酸鹽中析出硅酸膠體,所以硅酸的酸性小于碳酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學反應其△H=-122 kJ/mol,S=231 J/(mol·K),則此反應在下列哪種情況下可自發進行
A.在任何溫度下都能自發進行B.在任何溫度下都不能自發進行
C.僅在高溫下自發進行D.僅在低溫下自發進行
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物H是一種有機光電材料中間體。實驗室由芳香化合物A制備H的一種合成路線如下:
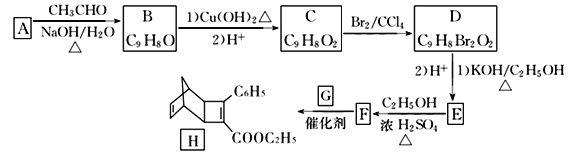
已知:①RCHO+CH3CHO![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
②![]()
回答下列問題:
(1)A的化學名稱是____________,D中含有的官能團名稱為_______________________。
(2)由F生成H的反應類型是_______________。
(3)G為甲苯的同分異構體,G的結構簡式為_________________。
(4)由D生成E第(1)步的化學方程式為:____________________________________________。
(5)芳香化合物X是F的同分異構體,X能與飽和碳酸氫鈉溶液放出CO2, 其核磁共振氫譜顯示有4種不同化學環境的氫,峰面積比為6:2:1:1。符合要求的X有____種。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外活動小組的同學在實驗室做鋅與濃硫酸反應的實驗中,甲同學認為產生的氣體是二氧化硫,而乙同學認為除二氧化硫氣體外,還可能產生氫氣。為了驗證哪位同學的判斷正確,丙同學設計了圖中的實驗裝置(鋅與濃硫酸共熱時產生的氣體為X,且該反應裝置略去)。
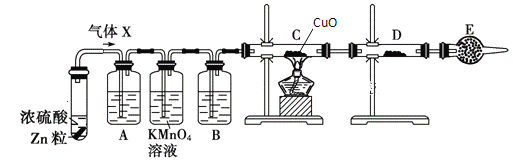
試回答下列問題:
(1)上述反應中生成二氧化硫的化學方程式為_______
(2)A中加入的試劑可能是_____,作用是_____;B中加入的試劑可能是_____,作用是_____;E中加入的試劑可能是_____,作用是_____
(3)可以證明氣體X中含有氫氣的實驗現象:C中______,D中____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化氯(ClO2)是一種高效消毒劑,可用如下反應制得:2NaClO3+Na2SO3+H2SO4![]() 2ClO2↑+2Na2SO4+H2O,下列說法正確的是( )
2ClO2↑+2Na2SO4+H2O,下列說法正確的是( )
A. 該反應屬于復分解反應
B. NaClO3被還原,發生還原反應
C. 反應中Na2SO3作氧化劑
D. 生成6.75 g ClO2時,轉移0.2 mol電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下列裝置完成相關實驗,能達到實驗目的的是
A.  驗證酸性HCl > H2SiO3
驗證酸性HCl > H2SiO3
B. 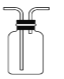 收集 HCl或 CO
收集 HCl或 CO
C. 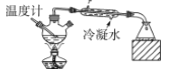 分離沸點不同且互溶的液體混合物
分離沸點不同且互溶的液體混合物
D. ![]() 分離酒精和水
分離酒精和水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據要求完成下列實驗過程(a、b為彈簧夾,加熱及固定裝置已略去)。

(1)驗證碳、硅非金屬性的相對強弱(已知酸性:亞硫酸>碳酸)。
①連接儀器、________________、加藥品后,打開a、關閉b,然后滴入濃硫酸,加熱。②銅與濃硫酸反應的化學方程式是________________,裝置A中試劑是_______。③能說明碳的非金屬性比硅強的實驗現象是_______________________。
(2)驗證SO2的氧化性、還原性和酸性氧化物的通性。
①在(1)①操作后打開b,關閉a。
②H2S溶液中有淺黃色渾濁出現,化學方程式是____________________。
③BaCl2溶液中無明顯現象,將其分成兩份,分別滴加下列溶液,將產生的沉淀的化學式填入下表相應的位置______。

寫出其中SO2顯示還原性生成沉淀的離子方程式:_____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知一氧化碳與水蒸氣的反應為:CO(g)+H2O (g)![]() CO2 (g)+H2 (g),在427℃時的平衡常數是9.4。回答下列問題:
CO2 (g)+H2 (g),在427℃時的平衡常數是9.4。回答下列問題:
(1)氫氣作為燃料與汽油相比,其優點是____________________________________________(答一條即可)。
(2)800℃時,在容積為2.0L的密閉容器中充入2.0mlCO(g)和3.0molH2O(g),保持溫度不變,4min后
反應達到平衡,測得CO的轉化率為60%。
①4min內H2的平均化學反應速率為__________mol/(L·min)。
②800℃時該反應的平衡常數值為__________。請結合題中的信息判斷該反應的△H__________0。
(3)一定條件下,設起始加入二氧化碳和氫氣且![]() = Z,在恒壓下.平衡時CO2的體積分數φ(CO2) 與Z和T(溫度)的關系如圖所示,下列說法正確的是(_____)
= Z,在恒壓下.平衡時CO2的體積分數φ(CO2) 與Z和T(溫度)的關系如圖所示,下列說法正確的是(_____)

A.該反應的焓變△H>0
B.圖中Z的大小為b>3>a
C.圖中x 點對應的平衡混合物中![]() = 3
= 3
D.溫度不變時,圖中x點對應的平衡在加壓后φ(CO2)減小
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com