
【題目】科學家最近又發現了一種新能源——“可燃冰”。它的主要成分是甲烷分子的結晶水合物(CH4·nH2O)。其形成過程是:埋于海底地層深處的大量有機質在缺氧環境中,厭氧型細菌把有機質分解,最后形成石油和天然氣,其中許多天然氣被包進水分子中,在海底的低溫與高壓下形成了類似冰的透明晶體,這就是“可燃冰”。這種“可燃冰”的晶體類型是( )
A. 離子晶體 B. 分子晶體 C. 原子晶體 D. 金屬晶體
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】反應mA(s)+nB(g)pC(g)△H<0,在一定溫度下,平衡時B的體積分數(B%)與壓強變化的關系如圖所示,下列敘述中一定正確的是( )
①m+n>p ②y點表示的正反應速率小于逆反應速率
③n>p ④x點比y點時的反應速率慢
⑤若降低溫度,該反應的平衡常數增大.
A.①②⑤
B.②④⑤
C.只有①③
D.①③⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某無色濟液中,只可能含有以下離子中的若干種:NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,,現取三份100mL溶液進行如下實驗:
①第一份加足量AgNO3溶液后,有白色沉淀產生。
②第二份加足量BaCl2溶液后,有白色沉淀產生,經洗滌、干燥后,沉淀質量為6.99g
③第三份逐滴滴加NaOH溶液,測得沉淀與NaOH溶液的體積關系如圖。根據上述實驗,試回答下列問題:

(1)該溶液中一定不存在的陰離子有_______。
(2)實驗③中NaOH溶液滴至35mL后發生的離子方程式為_______________________________。
(3)原得液確定含Mg2+、Al3+、NH4+,且n(Mg2+)∶n(Al3+)∶n(NH4+)=___________。
(4)實驗所加的NaOH溶液的濃度為________。
(5)溶液中存在一種不能確定的陽離子,請設計實驗方案加以檢驗_________________________。
(6)原溶液中NO3-的濃度為c(NO3-)則c(NO3-)的最小濃度為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是某種酶生物燃料電池的工作原理示意圖。下列說法中不正確的是
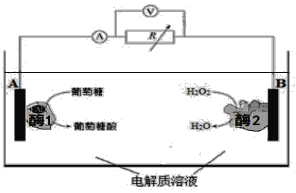
A. 葡萄糖是還原劑
B. 外電路中電子由A極移向B極
C. 溶液中H+ 由B極區移向A極區
D. B極電極反應式為:H2O2 +2H++2e-=== 2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四種短周期主族元素W、X、Y、Z的原子序數依次增大,W、X的簡單離子具有相同電子層結構,X的原子半徑是短周期主族元素原子中最大的,W與Y同族,Z與X形成的離子化合物的水溶液呈中性.下列說法正確的是( )
A.簡單離子半徑:W<X<Z
B.W與X形成的化合物溶于水后溶液呈堿性
C.氣態氫化物的熱穩定性:W<Y
D.最高價氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在恒容密閉容器中,可逆反應C(s)+CO2(g)![]() 2CO(g),達到平衡狀態的標志是( )
2CO(g),達到平衡狀態的標志是( )
①單位時間內生成n molCO2的同時生成n molC ②單位時間內生成n molCO2 的同時生成2n mol CO ③CO2 、CO的物質的量濃度之比為1: 2的狀態 ④混合氣體的密度不再改變的狀態 ⑤混合氣體的壓強不再改變的狀態 ⑥C的質量不再改變的狀態
A. ①④⑤⑥ B. ②④⑤⑥ C. ②③⑤⑥ D. ①②③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,回答下列有關問題:
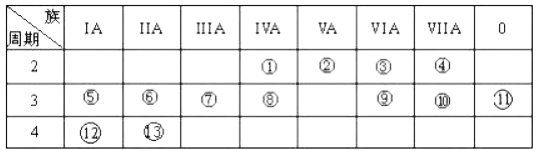
(1)寫出下列元素名稱:②_________;___________。
(2)在這些元素中,金屬性最強的元素是______(用元素符號表示),元素⑨與元素⑩相比,非金屬性較強的是___________(用元素符號表示)。下列表述中能證明這一事實的是______________。
a.常溫下⑨的單質和⑩的單質狀態不同
b. ⑩的氫化物比⑨的氫化物穩定
c.一定條件下⑨和⑩的單質都能與氫氧化鈉溶液反應
(3)⑦的最高價氧化物對應水化物與⑩的最高價氧化物對應水化物反應的離子方程式為:______。
(4)②的氣態氫化物與HC1在空氣中相遇有白煙生成,寫出白煙對應物質的電子式_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅和硫的化合物在化工、醫藥材料等領域具有廣泛的用途。回答下列問題:
(1)原子軌道是指電子在原子核外的___________,基態S原子的原子軌道數是____個。
(2)基態Cu原子中,核外電子占據的原子軌道為球形的最高能級符號是______,占據該能級的電子數為__________。
(3)Cl、S、Se在元素周期表中處于相鄰的位置,其第一電離能的大小順序為_______。
(4)下圖是含元素Cu、S的有機物的結構簡式:

①該有機化合物結構中含有的化學鍵類型是_______(填“共價鍵““離子鍵”或“共價鍵、離子鍵”)、配位鍵,其中1個該有機物分子中配位鍵數為_____個,這些配位鍵中提供孤電子對的元素是__________。
②S原子的雜化方式為_______、帶*N原子的雜化方式為_______。
(5)下圖是Cu-Au合金的一種立方晶體結構:

已知該合金的密度分dg/cm3,阿伏加德羅常數的值為NA,若Au原子的半徑為bpm(lpm=10-10cm),則銅原子的半徑為______cm(寫出計算表達式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物AX3和單質X2在一定條件下反應可生成化合物AX5 . 回答下列問題.
(1)已知AX3的熔點和沸點分別為﹣93.6℃和76℃,AX5的熔點為167℃.室溫時AX3與氣體X2反應生成1mol AX5 , 放出熱量123.8kJ.該反應的熱化學方程式為 .
(2)反應AX3(g)+X2(g)AX5(g)在容積為10L的密閉容器中進行.起始時AX3和X2均為0.2mol.反應在不同條件下進行,反應體系總壓強隨時間的變化如圖所示.
①下列不能說明反應達到平衡狀態的是 .
A.混合氣體的平均相對分子質量保持不變
B.混合氣體密度保持不變
C.體系中X2的體積分數保持不變
D.每消耗1molAX3同時消耗1molAX5
②計算實驗a從反應開始至達到平衡時的反應速率v(AX5)=(保留2位有效數字).
③圖中3組實驗從反應開始至達到平衡時的反應速率v(AX5)由大到小的次序為 (填實驗序號);與實驗a相比,其他兩組改變的實驗條件及判斷依據是:b、c . 該反應在實驗a和實驗c中的化學平衡常數的大小關系是KaKc(填“>、<或=”),其中Kc=(保留小數點后1位).
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com