
【題目】LiBH4為近年來儲氫材料領域的研究熱點。
(1)反應2LiBH4=2LiH+2B+3H2↑,生成22.4 L H2(標準狀況)時,轉移電子的物質的量為____mol。
(2)下圖是2LiBH4/MgH2體系放氫焓變示意圖,則:
Mg(s)+2B(s)=MgB2(s) △H=________。

(3)采用球磨法制備Al與LiBH4的復合材料,并對Al-LiBH4體系與水反應產氫的特性進行下列研究:
①如圖為25℃水浴時每克不同配比的Al-LiBH4復合材料與水反應產生H2體積隨時間變化關系圖。由圖可知,下列說法正確的是____(填字母)。

a.25℃時,純鋁與水不反應
b.25℃時,純LiBH4與水反應產生氫氣
c.25℃時,Al-LiBH4復合材料中LiBH4含量越高,1000s內產生氫氣的體積越大
②如圖為25℃和75℃時,Al-LiBH4復合材料[ω(LiBH4)=25%]與水反應一定時間后產物的X-射線衍射圖譜(X-射線衍射可用于判斷某晶態物質是否存在,不同晶態物質出現衍射峰的衍射角不同)。

從圖中分析,25℃時Al-LiBH4復合材料中與水完全反應的物質是___________(填化學式),產生Al(OH)3的化學方程式為_________________。
(4)如圖是直接硼氫化鈉-過氧化氫燃料電池示意圖。該電池工作時,正極附近溶液的pH________(填“增大”、“減小”或“不變”),負極的電極反應式為________________________。
【答案】2 -93 kJ·mol-1 ab LiBH4 2Al+6H2O=2Al(OH)3+3H2↑ 增大 BH4--8e-+8OH-=BO2-+6H2O
【解析】
(1)LiBH4中氫元素化合價為-1價,生成1mol氫氣轉移電子2mol;
(2)能量由上到下分別為1、2、3、4,則該反應的焓變為-(1+3-2-4)= -93 kJ·mol-1;
(3)①a、圖中當全為鋁時氣體為0,故純鋁與水不反應,故正確;
b、f線代表純LiBH4與水反應產生氫氣,故正確;
c、當材料含LiBH4為25%時(d線),產生氫氣的量最多,故錯誤;
答案選ab;
②由圖得出反應后已沒有LiBH4,但存在大量鋁,故其完全反應,與水完全反應的物質是LiBH4;鋁部分反應(有氫氧化鋁等鋁的產物),反應化學方程式為2Al+6H2O=2Al(OH)3+3H2↑;
(4)右室雙氧水得到電子為正極,電極反應式為H2O2+2e-=2OH-,故該極堿性增強,負極為BH4--8e-+8OH-=BO2-+6H2O。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】關于下列各裝置圖的敘述中,不正確的是
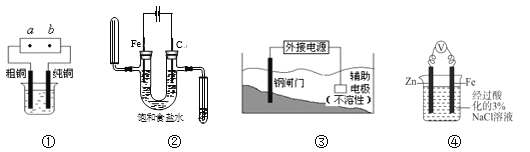
A. 用裝置①精煉銅,則a極為電源正極,電解質溶液可為CuSO4溶液
B. 用濕潤的淀粉-KI試紙檢驗裝置②中陽極氣體產物時,試紙變為藍色
C. 裝置③中鋼閘門應與外接電源的負極相連,該保護法稱為“犧牲陽極的陰極保護法”
D. 裝置④中反應一段時間后,取Fe電極附近溶液滴加鐵氰化鉀溶液,不會產生藍色沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】TiCl4是由鈦精礦(主要成分為TiO2)制備鈦(Ti)的重要中間產物,制備純TiCl4的流程示意圖如下:

資料:TiCl4及所含雜質氯化物的性質

(1)Ti是一種活潑金屬,原子核內有22個質子,它在周期表中的位置是____________。
(2)根據上表信息推測TiCl4中含有的化學鍵類型是_______________。
(3)MgCl2的電子式為____________。
(4)氯化產物冷卻至室溫,經過濾得到粗TiCl4混合液,則濾渣中含有_________________。
(5)精制過程:粗TiCl4經兩步蒸餾得純TiCl4如圖。

①物質a是__________________(填化學式)。
②T1應控制在______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種氣態烷烴和一種氣態烯烴,它們分子里的碳原子數相等.將1.0體積這種混合氣體在氧氣中完全燃燒,生成2.0體積的CO2和2.4體積的水蒸氣(氣體體積均在相同狀況下測定),則混合氣體中烷烴和烯烴的體積比為( )
A.3:1 B.1:3 C.2:3 D.3:2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列裝置正確且能達到對應實驗目的的是
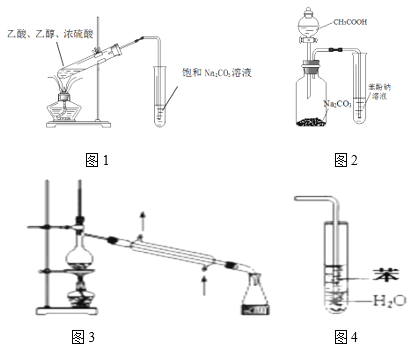
A. 用圖1裝置制備乙酸乙酯
B. 用圖2裝置比較乙酸、碳酸、苯酚的酸性強弱
C. 圖3常用于分離熔沸點不同的液體混合物
D. 圖4可用于吸收HCl氣體,并防止倒吸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把含(NH4)2SO4和NH4NO3的混合液aL分成兩等份。一份加入bmolNaOH并加熱,恰好把NH3全部趕出;另一份需消耗cmolBaCl2沉淀反應恰好完全,則原溶液中NO3-的濃度為()
A.![]() mol/LB.
mol/LB.![]() mol/LC.
mol/LC.![]() mol/LD.
mol/LD.![]() mol/L
mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學設計如下實驗方案,以分離NaCl和BaCl2兩種固體混合物,回答下列問題:

供選試劑:Na2CO3溶液、Na2SO4溶液、K2CO3溶液、K2SO4溶液、鹽酸
(1)操作②的名稱是___________。
(2)試劑a是___________(填化學式,下同),試劑b是___________,固體B是___________。
(3)加入試劑a所發生的化學反應方程式為________________________。
(4)該方案能否達到實驗目的?___________(填“能”或“不能”)。若不能,應如何改進(若能,此問不用回答)________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知C—C可以繞鍵軸旋轉,對于結構簡式如圖所示的烴,下列說法正確的是
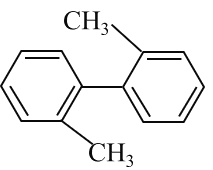
A.該物質不能發生加成反應
B.分子中至少有9個碳原子處于同一平面上
C.該烴的一氯取代物最多有5種
D.該烴是苯的同系物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F是核電荷數依次增大的六種短周期主族元素,A元素的原子核內只有1個質子;B元素的原子半徑是其所在主族中最小的,B的最高價氧化物對應水化物的化學式為HBO3;C元素原子的最外層電子數比次外層多4;C的陰離子與D的陽離子具有相同的電子排布,兩元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置_________
(2)F元素的最高價氧化物對應的水化物的化學式為________。
(3)元素C、D、E形成的簡單離子半徑由小到大的順序________(用離子符號表示)。
(4)寫出化合物D2C2的電子式:________。
(5)E、F的簡單離子的還原性大小順序為:_________。
(6)已知E單質和F單質的水溶液反應會生成兩種強酸,其離子方程式為_______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com