
【題目】濃硫酸與金屬的反應是我們一直探討和研究的重要課題之一。
Ⅰ.銅與濃硫酸反應的過程中,發現有黑色物質出現,且黑色物質為Cu2S。產生Cu2S的反應為aCu+bH2SO4![]() cCu2S+dCuSO4+eH2O。則a:b=______.
cCu2S+dCuSO4+eH2O。則a:b=______.
Ⅱ.為研究鐵質材料與熱濃硫酸的反應,某學習小組用碳素鋼(即鐵和碳的合金)進行了以下探究活動:
(探究一)(1)常溫下,工業上用鐵質容器盛放冷的濃硫酸,其原因是________;
(2)鐵與濃硫酸在加熱時的化學方程式為:______________;
(3)稱取碳素鋼6.0g放入15.0ml濃硫酸中,加熱,充分反應后得到溶液X并收集到混合氣體Y。
①甲同學認為X中除Fe3+之外還可能含有Fe2+。若要確認其中的Fe2+,應選用____________;
a.KSCN溶液和氯水 b.鐵粉和KSCN溶液 c.濃氨水 d.酸性KMnO4溶液
②乙同學取560mL(標準狀況)氣體Y通入足量溴水中,發生反應后加入足量BaCl2溶液,經適當操作后得干燥固體4.66g。由此推知氣體Y中SO2的體積分數為_______;
(探究二)根據上述實驗中SO2體積分數的分析,丙同學認為氣體Y中還可能含有Q1和Q2兩種氣體,其中Q1氣體在標準狀況下密度為0.0893g/L。為此設計了下列探究實驗裝置(圖中夾持儀器省略,假設有關氣體完全反應)。
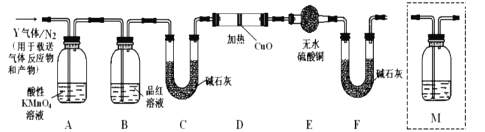
(4)裝置B中試劑的作用是__________;
(5)分析Y氣體中的![]() 氣體是如何生成的___________(用化學方程式表示):
氣體是如何生成的___________(用化學方程式表示):
(6)為確認![]() 的存在,需在裝置中添加洗氣瓶M于___________;
的存在,需在裝置中添加洗氣瓶M于___________;
a.A之前 b.A-B間 c.B-C間 d.C-D間
(7)如果氣體Y中含有![]() ,預計實驗現象應是_________________。
,預計實驗現象應是_________________。
Ⅲ.將一定質量的Zn與100mL一定濃度的H2SO4充分反應:
(1)若反應前c(H2SO4)=12.0mol/L,反應后稱量剩余鋅發現質量減少了65.0g。將反應后的溶液稀釋至1L,此時溶液中c(SO42-)=______mo/L,產生SO2體積(標準狀況下)V(SO2)=______L;
(2)將(1)中產生的氣體緩緩通入100mL a mo/L NaOH溶液中,SO2和NaOH都完全消耗,則a的取值范圍為______。
【答案】5:4 鐵釘表面被鈍化(或其他合理答案) 2Fe+6H2SO4(濃)![]() Fe2(SO4)3+3SO2↑+6H2O d 80% 檢驗SO2是否除盡 C+2H2SO4(濃)
Fe2(SO4)3+3SO2↑+6H2O d 80% 檢驗SO2是否除盡 C+2H2SO4(濃)![]() CO2↑+2SO2↑+2H2O c D中固體由黑色變紅色和E中固體由白色變藍色 1 4.48 2≤a≤4
CO2↑+2SO2↑+2H2O c D中固體由黑色變紅色和E中固體由白色變藍色 1 4.48 2≤a≤4
【解析】
I.根據轉移電子及原子守恒配平方程式,從而確定a、b關系;
(1)根據濃硫酸的強氧化性及Fe被氧化產物的性質分析;
(2)鐵與濃硫酸在加熱時反應產生硫酸鐵、二氧化硫和水;
(3)①亞鐵離子有還原性,能還原酸性高錳酸鉀溶液而使其褪色;
②氣體Y通入足量溴水中,發生SO2+Br2+2H2O=2HBr+H2SO4反應,根據硫酸鋇與二氧化硫的關系式計算二氧化硫的體積,再根據體積分數公式計算;
(4)二氧化硫能使品紅溶液褪色,據此判斷是否含有二氧化硫;
(5)碳素鋼中含有碳,加熱條件下,碳和濃硫酸反應生成二氧化碳;
(6)用澄清石灰水檢驗二氧化碳,首先要排除二氧化硫的干擾;
(7)Q1氣體,在標準狀況下,密度為0.0893g/L,其相對分子質量為2,所以是氫氣,氫氣檢驗還原性,能含有氧化銅同時生成水,水能使無水硫酸銅變藍.
III.(1)硫酸完全反應,發生反應:Zn+2H2SO4(濃)=ZnSO4+SO2↑+2H2O,Zn+H2SO4=ZnSO4+H2↑,結合方程式計算;
(2)SO2與NaOH反應產生的鹽可能為NaHSO3、Na2SO3,也可能是二者的混合物,用極值法計算。
I. aCu+bH2SO4![]() cCu2S+dCuSO4+eH2O中Cu元素化合價由0價變為+1價、+2價、S元素化合價由+6價變為-2價,轉移電子數為6,根據轉移電子守恒及原子守恒配平方程式為5Cu+4H2SO4
cCu2S+dCuSO4+eH2O中Cu元素化合價由0價變為+1價、+2價、S元素化合價由+6價變為-2價,轉移電子數為6,根據轉移電子守恒及原子守恒配平方程式為5Cu+4H2SO4![]() Cu2S+3CuSO4+4H2O,所以a:b=5:4;
Cu2S+3CuSO4+4H2O,所以a:b=5:4;
(1)中常溫下,工業上用鐵質容器盛放冷的濃硫酸,是由于濃硫酸具有強的氧化性,會將Fe表面氧化產生一層致密的氧化物薄膜,阻止金屬的進一步反應,即產生鈍化現象;
(2)在加熱時,Fe與濃硫酸發生氧化還原反應,產生硫酸鐵、二氧化硫和水,根據電子守恒、原子守恒,可得反應方程式:2Fe+6H2SO4(濃)![]() Fe2(SO4)3+3SO2↑+6H2O;
Fe2(SO4)3+3SO2↑+6H2O;
(3)①因為有Fe3+的干擾,可以利用Fe2+具有還原性、可以被酸性KMnO4溶液氧化,發生氧化還原反應使高錳酸鉀溶液褪色,故合理選項是d;
②氣體Y通入足量溴水中,發生反應,SO2+Br2+2H2O=2HBr+H2SO4,H2SO4+BaCl2=BaSO4↓+2HCl,所以硫酸鋇和二氧化硫之間的關系式為SO2~BaSO4,n(SO2)=n(BaSO4)=![]() =0.02mol,所以SO2氣體的體積為V(SO2)=0.02mol×22.4L/mol=0.448l=448mL,所以二氧化硫的體積分數為(0.448mL÷560ml)×100%=80%;
=0.02mol,所以SO2氣體的體積為V(SO2)=0.02mol×22.4L/mol=0.448l=448mL,所以二氧化硫的體積分數為(0.448mL÷560ml)×100%=80%;
(4)裝置B中試劑是品紅溶液,其作用是檢驗二氧化硫是否除盡;
(5)碳素鋼中含有碳,加熱條件下,碳能和濃硫酸反應生成二氧化硫、二氧化碳和水,反應方程式為C+2H2SO4(濃)![]() CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;
(6)二氧化硫和二氧化碳都能使澄清石灰水變渾濁,但二氧化硫還能使品紅溶液褪色,所以要檢驗二氧化碳必須排除二氧化硫的干擾,B裝置是檢驗二氧化硫是否除盡,所以澄清石灰水應放置在B和C之間,即在通入堿石灰之前檢驗,故合理選項是c;
(7)Q1氣體,在標準狀況下,密度為0.0893g/L,則其摩爾質量為M=0.0893g/L×22.4L/mol=2g/mol,其相對分子質量為2,因此Q1為H2,氫氣具有還原性,能將黑色的CuO生成紅色的Cu單質,同時產生水,水能使無水硫酸銅變為藍色,這是檢驗水的特征反應,乙醇若D中氧化銅變紅,E中無水硫酸銅變藍,則證明含有氫氣;
III.(1) 一定質量的Zn與
Zn+2H2SO4(濃)=ZnSO4+SO2↑+2H2O,Zn+H2SO4=ZnSO4+H2↑,
x 2x x x y y y
由題意可知:x+y=1;2x+y=1.2,解得x=0.2mol,y=0.8mol,因此將反應后的溶液稀釋至1L,此時溶液中c(SO42-)=![]() =1mol/L,反應產生的SO2氣體在標準狀況下的體積V(SO2)=0.2mol×22.4L/mol=4.48L;
=1mol/L,反應產生的SO2氣體在標準狀況下的體積V(SO2)=0.2mol×22.4L/mol=4.48L;
(2) SO2與NaOH反應產生的鹽可能為酸式鹽NaHSO3,也可能為正鹽Na2SO3,也可能是二者的混合物。若SO2與NaOH反應產生的鹽若完全為NaHSO3,根據元素守恒可得n(NaOH)=n(SO2)=0.2mol,0.1L×amol/L=0.2mol,所以a=2mol/L;若完全為正鹽Na2SO3,則n(NaOH)=2n(SO2)=0.4mol,0.1L×amol/L=0.4mol,所以a=4mol/L;若形成的鹽既含有NaHSO3,也含有Na2SO3,則需要的NaOH溶液的物質的量濃度在2到4之間,即2≤a≤4。


科目:高中化學 來源: 題型:
【題目】關于下列四種烴的有關說法正確的是
①![]() ②
②
③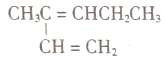 ④
④
A. ①催化加氫可生成3-甲基已烷 B. ③與④催化加氫后的產物質譜圖完全一樣
C. ③中所有碳原子有可能共平面 D. ②在同一直線上的碳原子有5個
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】前四周期元素A、B、C、D、E、F原子序數依次增大,其相關性質如下表所示:
A | 2p能級電子半充滿 |
B | 與A同周期,且原子核外有2個未成對電子 |
C | 基態原子核外有6個原子軌道排有電子,且只有1個未成對電子 |
D | 其基態原子外圍電子排布為msnmpn+2 |
E | 前四周期元素中,E元素基態原子未成對電子數最多 |
F | 基態F+各能級電子全充滿 |
請根據以上情況,回答下列問題:
(1)E元素基態原子核外有_______種能量不同的電子,電子排布式為________________,寫出F元素基態原子的價電子排布圖________________。
(2)B和C可形成一種同時含有共價鍵和離子鍵的化合物,其電子式為________。
(3)A、B、C、D四種元素:(用元素符號表示,下同)
①原子半徑由小到大的順序是___________________;
②第一電離能由大到小的順序為__________________;
③電負性由大到小的順序是____________________。
(4)判斷下列分子或離子中空間構型是V形的是________(填寫序號)。
a.SO2 b.H2O c.NO![]() d.NO
d.NO![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯,硫,氯元素廣泛存在于自然界中,對人類生命和生活具有重要意義。
(1)氯氣的顏色:______;![]() 在
在![]() 中燃燒火焰顏色:__________。
中燃燒火焰顏色:__________。
(2)濃硫酸具有:①酸性②強氧化性③吸水性④脫水性,下列現象硫酸所表現出的性質為(填編號)
干燥氯氣______,使蔗糖變黑________,吸收氨氣_________,與銅反應________。
(3)為了提高農作物的產量,德國化學家哈伯、波施等成功地開發了將氮氣轉化為氨氣的生產工藝。請用化學方程式表示工業合成氨的反應原理:________;實驗室制取氨氣的化學方程式____________。
(4)自然界形成NO的化學方程式:_____________。氮氧化物(![]() )污染環境,若用
)污染環境,若用![]() ,溶液吸收
,溶液吸收![]() 可生成
可生成![]() ,9.2g
,9.2g![]() 和
和![]() 溶夜完全反應時轉移電子0.1mol,則反應的離子方程式為_____________。
溶夜完全反應時轉移電子0.1mol,則反應的離子方程式為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在合成氨反應中,將等物質的量的氮氣和氫氣充入一密閉容器中發生反應,測得 2min 內氨的平均反應速率為 2 mol·L-1·min -1,2min 末 N2 的濃度為7 mol·L-1,則氫氣的起始濃度為
A.9 mol·L-1
B.6 mol·L-1
C.3 mol·L-1
D.2 mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以Al和不同的銅鹽溶液間的反應為實驗對象,探索Al與不同銅鹽溶液反應的多樣性。
實驗 | 向試管中加入2ml溶液 | 實驗現象 |
| 實驗Ⅰ:0.5mol/LCuCl2溶液 | 15s:大量氣泡且有紅色物質析出 60s:反應進一步加快且反應劇烈放熱,液體幾乎沸騰 120s:鋁片反應完,試管中析出大量蓬松的紅色物質 |
實驗Ⅱ:0.5mol/LCuSO4溶液 | 15s無明顯現象 60s:鋁片表面有極少氣泡 120s:有少量氣泡溢出,鋁片邊緣有很少紅色物質生成 |
(1)對實驗Ⅰ進行研究
①實驗Ⅰ中生成紅色物質的離子方程式為: __________________________________________
②請寫出60s后反應進一步加快可能的原因(寫出一條)________________________________________________________________
(2)對實驗Ⅱ進行研究
①實驗Ⅱ反應明顯比實驗Ⅰ緩慢,說明Al與不同的銅鹽溶液反應呈現多樣性,其原因可能有:
②假設一:SO42-對Al與Cu2+的置換反應存在一定的抑制作用。
③假設二:________________________________________________
(3)為進一步研究上述假設,設計如下實驗:
實驗 | 向試管中加入2mL溶液 | 實驗現象 |
| 實驗Ⅲ:0.5mol/LCuCl2溶液+1g Na2SO4固體 | 加入 Na2SO4固體后速率幾乎不變,仍有大量氣泡產生,紅色物質生成且劇烈放熱,鋁片反應完全,溶液沸騰 |
實驗Ⅳ:0.5mol/L CuCl2溶液+5g Na2SO4固體 | 加入Na2SO4固體后速率幾乎不變,仍有大量氣泡產生,紅色物質生成且劇烈放熱,鋁片反應完全,溶液沸騰 | |
實驗Ⅴ:0.5mol/LCuSO4溶液+0.02mol NaCl固體 | 未加入 NaCl固體前幾乎沒現象,加入后,鋁片表面迅速產生大量氣體和紅色物質,溶液溫度上升至沸騰,鋁反應完全 | |
實驗Ⅵ:0.5mol/LCuSO4溶液+_________ NH4Cl固體 | 未加入 NH4Cl固體前幾乎沒現象,加入后,鋁片表面迅速產生大量氣體和紅色物質,溶液溫度上升至沸騰,鋁反應完全 |
①實驗Ⅵ的設計目的是:_______________________________________________
②其中,實驗Ⅰ與實驗Ⅲ、Ⅳ做對比,結論為:______________________________
③其中,實驗Ⅱ與實驗Ⅴ、Ⅵ做對比,結論為:________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表標出的是元素周期表的一部分元素,回答下列問題:
1 | ||||||||||||||||||
2 | A | B | C | |||||||||||||||
3 | D | E | F | G | H | I | J | K | ||||||||||
4 | M | |||||||||||||||||
(1)在上表用字母標出的12種元素中,化學性質最不活潑的是____(用元素符號表示,下同),金屬性最強的是___,除稀有氣體外第三周期中原子半徑最小的是____,屬于過渡元素的是___(該空格用表中的字母表示)。
(2)J的氫化物的電子式為____,最高價氧化物對應的水化物的化學式為___。
(3)為比較元素A和G的非金屬性強弱,用下圖所示的裝置進行實驗(夾持儀器已略去,裝置氣密性良好)。溶液B應該選用_____溶液,作用是_____,能說明A和G非金屬性強弱的化學方程式是______。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述錯誤的是
A.根據鹽酸能導電可判斷:氯化氫為電解質
B.根據溶液顯堿性可判斷:純堿屬于堿類
C.根據是否有電子轉移可判斷:漂白粉在空氣中久置失效,其中存在氧化還原反應
D.根據發揮漂白作用的物質性質推斷:氯水和活性炭的漂白原理不同
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com