
向Cu、Cu2O和CuO組成的混合物中,加入1 L 0.6 mol·L -1HNO3溶液恰好使混合物溶解,同時收集到2240 mL NO氣體(標準狀況)。(已知:Cu2O+2H+=Cu+Cu2++H2O)
(1)Cu2O跟稀硝酸反應(yīng)的離子方程式 。
(2)若將上述混合物用足量的H2加熱還原,所得到固體的質(zhì)量為 g。
(3)若混合物中含0.1 mol Cu,將該混合物與稀硫酸充分反應(yīng),至少消耗H2SO4的物
質(zhì)的量為 。
(1)3Cu2O+ 14H+ + 2NO3-=6Cu2+ +2 NO↑+ 7H2O (2)16 (3)0.1mol
解析試題分析:(1)Cu2O跟稀硝酸反應(yīng)的離子方程式為3Cu2O+ 14H+ + 2NO3-=6Cu2+ +2 NO↑+ 7H2O。(2)n(HNO3)=0.6mol,n(NO)=2.24L÷22.4L/mol=0.1mol.所以n(Cu(NO3)2)=1/2n(NO3-)=0.25mol.所以若將上述混合物用足量的H2加熱還原,所得到固體的質(zhì)量即為Cu的質(zhì)量。m(Cu)= 0.25mol×64g/mol=16g。(3)若混合物中含0.1 mol Cu,根據(jù)方程式3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O可知Cu產(chǎn)生的NO的物質(zhì)的量為0.2/3mol,則Cu2O與硝酸反應(yīng)產(chǎn)生的NO的物質(zhì)的量為0.1mol-2/3×0.1mol=0.1/3mol.在根據(jù)3Cu2O+ 14H+ + 2NO3-=6Cu2+ +2 NO↑+ 7H2O可計算出Cu2O的物質(zhì)的量為0.05mol.所以CuO物質(zhì)的量為(0.15-0.2/3-0.1/3)mol=0.05mol結(jié)合方程式:CuO+H2SO4=CuSO4+H2O; Cu2O+H2SO4="Cu+" Cu SO4+H2O.可知:消耗的H2SO4的物質(zhì)的量為0.05mol+0.05mol=0.1mol.
考點:考查Cu、Cu2O和CuO與硝酸、硫酸反應(yīng)原理及離子方程式的書寫及個組分含量的計算。


科目:高中化學 來源: 題型:填空題
氮氧化物是大氣污染物之一,消除氮氧化物的方法有多種。
(1)利用甲烷催化還原氮氧化物。已知:
CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H =-574 kJ/mol
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H =-1160 kJ/mol
則CH4 將NO2 還原為N2 的熱化學方程式為 。
(2)利用NH3催化還原氮氧化物(SCR技術(shù))。該技術(shù)是目前應(yīng)用最廣泛的煙氣氮氧化物脫除技術(shù)。 反應(yīng)的化學方程式為:2NH3(g)+NO(g)+NO2(g)  2N2(g)+3H2O(g) ΔH < 0
2N2(g)+3H2O(g) ΔH < 0
為提高氮氧化物的轉(zhuǎn)化率可采取的措施是 (寫出1條即可)。
(3)利用ClO2氧化氮氧化物。其轉(zhuǎn)化流程如下:
NO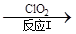 NO2
NO2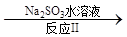 N2
N2
已知反應(yīng)Ⅰ的化學方程式為2NO+ ClO2 + H2O = NO2 + HNO3 + HCl,則反應(yīng)Ⅱ的化學方程式是 ;若生成11.2 L N2(標準狀況),則消耗ClO2 g 。
(4)利用CO催化還原氮氧化物也可以達到消除污染的目的。
已知質(zhì)量一定時,增大固體催化劑的表面積可提高化學反應(yīng)速率。如圖是反應(yīng)2NO(g) + 2CO(g) 2CO2(g)+ N2(g) 中NO的濃度隨溫度(T)、等質(zhì)量催化劑表面積(S)和時間(t)的變化曲線。據(jù)此判斷該反應(yīng)的△H 0 (填“>”、“<”或“無法確定”);催化劑表面積S1 S2 (填“>”、“<”或“無法確定”)。
2CO2(g)+ N2(g) 中NO的濃度隨溫度(T)、等質(zhì)量催化劑表面積(S)和時間(t)的變化曲線。據(jù)此判斷該反應(yīng)的△H 0 (填“>”、“<”或“無法確定”);催化劑表面積S1 S2 (填“>”、“<”或“無法確定”)。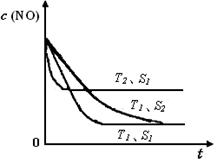
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
已知 2Na2O2+2CO2=2Na2CO3+O2,因此Na2O2可在呼吸面具和潛水艇里作供氧劑。
(1)請在答卷上用雙線橋法標出上述方程式的電子轉(zhuǎn)移方向和數(shù)目。
(2) 是還原劑, 是還原產(chǎn)物。
(3)若轉(zhuǎn)移3mol電子,則所產(chǎn)生的氧氣在標準狀況下的體積為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
二氧化氯(ClO2)為一種黃綠色氣體,是國際上公認的高效、廣譜、快速、安全的殺菌消毒劑。
(1)工業(yè)上制備ClO2的反應(yīng)原理為2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①濃鹽酸在反應(yīng)中顯示出來的性質(zhì)是________。
| A.只有還原性 | B.還原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
硝酸是一種強氧化性、腐蝕性的強酸,其還原產(chǎn)物因硝酸濃度的不同而有變化,從總體上說,硝酸濃度越高,平均每分子硝酸得到的電子數(shù)越少,濃硝酸的還原產(chǎn)物主要為NO2,稀硝酸的還原產(chǎn)物主要為NO。 實驗室中,常用Cu與濃HNO3反應(yīng)制取NO2,用Cu與稀HNO3反應(yīng)制取NO。
(1)請寫出實驗室中用Cu與濃HNO3反應(yīng)制取NO2的化學方程式:_____________。
(2)該反應(yīng)中發(fā)生氧化反應(yīng)的物質(zhì)是__________,1 mol氧化劑_________(填“得到”或“失去”)_______ mol電子。
(3)48.0 g Cu與適量的濃HNO3反應(yīng),銅全部作用后,共收集到22.4 L氣體(標準狀況下),反應(yīng)中消耗HNO3的物質(zhì)的量可能是( )
A.1.5 mol B.2.0 mol C.2.5 mol D.3.0 mol
(4)實際上硝酸不僅可被還原為NO2或NO,濃度更稀時硝酸還可以被還原為N2O、N2、NH4NO3等。請將3種物質(zhì): FeSO4、Fe(NO3)3和Fe2(SO4)3分別填入下面對應(yīng)的橫線上,組成一個未配平的化學方程式。
HNO3 + ______  ______ + ______ + N2O↑ + H2O
______ + ______ + N2O↑ + H2O
并寫出配平后的離子方程式:_________________________。
(5)硝酸的還原產(chǎn)物NO、NO2、N2O等對環(huán)境均有副作用,為了可持續(xù)發(fā)展,當今社會提出的一個新概念——“綠色化學”,它要求從經(jīng)濟、環(huán)保和技術(shù)上設(shè)計可行的化學反應(yīng),則下列由單質(zhì)銅制取硝酸銅的方法可行且符合“綠色化學”的是( )
A.Cu  Cu(NO3)2
Cu(NO3)2
B.Cu 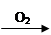 CuO
CuO Cu(NO3)2
Cu(NO3)2
C.Cu 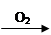 CuO
CuO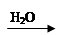 Cu(OH)2
Cu(OH)2 Cu(NO3)2
Cu(NO3)2
D.Cu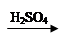 CuSO4
CuSO4 Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
實驗室可用KMnO4固體和濃鹽酸反應(yīng)制氯氣,反應(yīng)的化學方程式如下:
2KMnO4+16HCl(濃) =2KCl+2MnCl2+5Cl2↑+8H2O。
(1)該反應(yīng)中氧化劑是_____________,還原劑是__________________。
(2)若反應(yīng)中有0.20 mol 電子發(fā)生轉(zhuǎn)移,生成氯氣的體積為 (標準狀況),被氧化的HCl的物質(zhì)的量是 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
部分弱酸的電離平衡常數(shù)如下表:
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 電離平衡常數(shù) (25℃) | 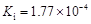 |  | 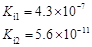 | 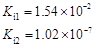 |
 ,但它的氧化性比硫酸還要強。在酸性介質(zhì)中,碲酸可將HI氧化成I2,方程式如下:
,但它的氧化性比硫酸還要強。在酸性介質(zhì)中,碲酸可將HI氧化成I2,方程式如下: TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O ,試配平上述化學方程式。
,試配平上述化學方程式。查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(6分)下列反應(yīng)原理可以用于檢查司機是否酒后開車。
K2Cr2O7+C2H5OH+H2SO4—Cr2(SO4)3+CH3COOH+K2SO4+
(1)在反應(yīng)中,氧化劑是 。如果在反應(yīng)中生成1molCr3+,轉(zhuǎn)移電子數(shù)為 。(用NA表示阿伏加德羅常數(shù))
(2)寫出上述化學方程式所缺項(填化學式) 。
(3)乙醇(C2H5OH)和乙醚(CH3CH2OCH2CH3)的沸點分別是78.5℃、34.5℃,分離二者混合物的方法是 ,乙醇比乙醚的沸點高的原因是 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
高錳酸鉀(KMnO4)是一種常用的氧化劑。
(1)有下列變化:CO32-→CO2、C2O42-→CO2、Fe3+→Fe2+,找出其中一個變化與“MnO4-→Mn2+”組成一個反應(yīng),寫出該反應(yīng)配平后的離子方程式____________________。
(2)不同條件下高錳酸鉀可發(fā)生不同如下反應(yīng):
MnO4-+5e+8H+→Mn2++4H2O MnO4-+3e+2H2O→MnO2+4OH- MnO4-+e→MnO42-
由此可知,高錳酸根離子(MnO4-)反應(yīng)后的產(chǎn)物與 有關(guān)。
(3)高錳酸鉀可代替二氧化錳用來制取Cl2,反應(yīng)中氧化劑和還原劑物質(zhì)的量之比為_____________。
(4)高錳酸鉀溶液與硫化亞鐵在酸性條件下發(fā)生如下反應(yīng):
10FeS + 6KMnO4 + 24H2SO4 → 3K2SO4 + 6MnSO4 + 5Fe2(SO4)3 + 10S + 24H2O
若上述反應(yīng)前后固體的質(zhì)量減少了2.8g,則硫元素與KMnO4之間發(fā)生電子轉(zhuǎn)移的數(shù)目為 。
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com