
A、B、C、 D、 E五種溶液分別是NaOH、NH3·H2O、CH3COOH 、HCl、NH4HSO4中的一種。常溫下進行下列實驗:
①將1 L pH=3的A溶液分別與0.001mol·L-1 xL B溶液、0.001mol·L-1 yL D溶液充分反應至中性,x、y大小關系為: y<x;
②濃度均為0.1mol·L-1A和E溶液,pH:A<E;
③濃度均為0.1mol·L-1C與D溶液等體積混合,溶液呈酸性。
回答下列問題:
(1)D是 溶液,判斷理由是 。
(2)用水稀釋0.1 mol·L-1B時,溶液中隨著水量的增加而減小的是 (填寫序號)
①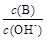 ②
② 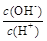 ③ c(H+)和c(OH-)的乘積 ④ OH-的物質的量
③ c(H+)和c(OH-)的乘積 ④ OH-的物質的量
(3)OH-濃度相同的等體積的兩份溶液A和E,分別與鋅粉反應,若最后僅有一份溶液中存在鋅粉,且放出氫氣的質量相同,則下列說法正確的是________(填寫序號)
①反應所需要的時間E>A
②開始反應時的速率A>E
③參加反應的鋅粉物質的量A=E
④反應過程的平均速率 E>A
⑤A溶液里有鋅粉剩余
⑥E溶液里有鋅粉剩余
(4)將等體積、等物質的量濃度B和C混合后溶液,升高溫度(溶質不會分解)溶液pH隨溫度變化如圖中的_________曲線(填寫序號) 。室溫下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有離子的物質的 量濃度由大到小的順序為 。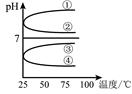
(1)NaOH (2分)
中和酸性物質A只有NaOH、NH3·H2O,物質的量的A與等物質的量濃度B和D混合呈中性,D的用量少,說明D堿性比B的堿性強,所以D是NaOH。 (2分)
(2)①② (2分)
(3)③④⑤ (2分)
(4)④ (2分)
(5) c(Na+)> c(SO42-)>c(NH4+)>c(OH-)=c(H+) (2分)
解析試題分析:根據中和酸性物質A只有NaOH、NH3?H2O,物質的量的A與等物質的量濃度B和D混合呈中性,D的用量少,說明D堿性比B的堿性強,所以D是NaOH,B為NH3?H2O;根據濃度均為0.1mol?L-1C與D溶液等體積混合,溶液呈酸性,則C為NH4HSO4;根據濃度均為0.1mol?L-1A和E溶液,pH:A<E,則A為HCl,E為CH3COOH;然后根據問題回答,
(1)中和酸性物質A只有NaOH、NH3?H2O,物質的量的A與等物質的量濃度B和D混合呈中性,D的用量少,說明D堿性比B的堿性強,所以D是NaOH,故答案為:NaOH;
(2)①、由NH3?H2O?OH-+NH4+可知,加水促進電離,則n(NH3?H2O)減少,n(OH-)增大,則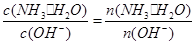 減小,故①正確;
減小,故①正確;
②、由NH3?H2O?OH-+NH4+可知,加水促進電離,則n(NH3?H2O)減少,n(OH-)增大,c(NH3?H2O)、c(OH-)都減小,c(H+)減小,則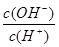 減小,故②正確;
減小,故②正確;
③、因加水稀釋時,溫度不變,則c(H+)和c(OH-)的乘積不變,故③錯誤;
④、由NH3?H2O?OH-+NH4+可知,加水促進電離,OH-的物質的量增大,故④錯誤;
故答案為:①②;
(3)①根據酸能與鋅反應得到氫氣,隨著反應的進行,CH3COOH不斷電離出H+,反應速率比鹽酸中快,產生的氫氣一樣多,反應所需要的時間HCl>CH3COOH,故①錯誤;
②根據酸能與鋅反應得到氫氣,開始溶液中c(H+)相等,反應時的速率HCl=CH3COOH,故②錯誤;
③根據酸能與鋅反應得到氫氣,若最后僅有一份溶液中存在鋅,放出氫氣的質量相同,說明鹽酸中鋅剩余,CH3COOH中鋅完全反應,參加反應的鋅的物質的量相等,故③正確;
④根據酸能與鋅反應得到氫氣,隨著反應的進行,CH3COOH不斷電離出H+,反應速率比鹽酸中快,故④正確;
⑤根據酸能與鋅反應得到氫氣,若最后僅有一份溶液中存在鋅,放出氫氣的質量相同,說明鹽酸中鋅剩余,CH3COOH中鋅完全反應,參加反應的鋅的物質的量相等,故⑤正確;
⑥根據酸能與鋅反應得到氫氣,若最后僅有一份溶液中存在鋅,放出氫氣的質量相同,說明鹽酸中鋅剩余,CH3COOH中鋅完全反應,參加反應的鋅的物質的量相等,故⑥錯誤;
(4)等體積、等物質的量濃度NH3?H2O和與NH4HSO4混合后溶液發生反應:
NH3?H2O+NH4HSO4=(NH4)2SO4+H2O,(NH4)2SO4要發生水解:NH4++H2O?NH3?H2O+H+,溶液呈酸性,加熱水解平衡正向移動,c(H+)增大,pH減小,
(5)NH4HSO4中滴入NaOH溶液,NaOH首先與NH4HSO4電離出的H+作用,因為H+結合OH-的能力比NH4+結合OH-的能量強(原因是產物H2O比NH3?H2O更難電離).當加入等摩爾的NaOH時,正好將H+中和,此時c(Na+)=c(SO42-),但此時溶液中還有NH4+,NH4+水解使溶液呈酸性,因此要使溶液呈中性,則還需繼續滴入NaOH,當然到中性時c(OH-)=c(H+),c(Na+)>c(SO42-)>c(NH4+)
考點:考查電解質溶液之間的反應,涉及到強電解質、弱電解質的電離、鹽類的水解及溶液的pH值、離子濃度大小的比較等知識。


 全能測控期末小狀元系列答案
全能測控期末小狀元系列答案科目:高中化學 來源: 題型:填空題
)2013年全國各地連續出現了嚴重的霧霾天氣,給人們的出行及身體造成了極大的危害,因此研究NO2、SO2、CO等大氣污染氣體的處理具有重要意義。
I.脫硫技術能有效控制SO2對空氣的污染。
(1)海水呈弱堿性,主要含有Na+、K+、Ca2+、Mg2+、CI-、SO42-、Br-、HCO3-等離子。含SO2的煙氣可利用海水脫硫,其工藝流程如下圖所示: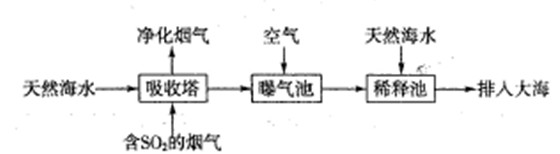
①向曝氣池中通入空氣的目的是
②通入空氣后曝氣池中海水與天然海水相比,濃度沒有明顯變化的離子是 。
a.Cl- B.SO42- C.HCO3-
(2)用NaOH溶液吸收煙氣中的SO2,將所得的Na2SO3溶液進行電解,可循環再生NaOH,同時得到H2SO4,其原理如下圖所示。(電極材料為石墨)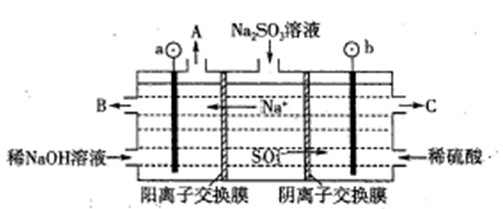
①圖中b極要連接電的(填“正”或“負”) 極,C口流出的物質是 。
②SO32-放電的電極反應式為
③電解過程中陰極區堿性明顯增強,用平衡移動原理解釋原因 。
II.我國的能消費結構以燃煤為主,將煤氣化可減少環境污染,但煤氣化過程中能產生有害氣體H2S,用足量的Na2CO3溶液可吸收,該反應的離子方程式為 。
(已知:H2S Kal=9.1×10-8;Ka2=1.1 ×10-12;H2CO3 Kal=4.30×10-7;Ka2=5.61 ×10-11)
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
制備鋅印刷電路板是用稀硝酸腐蝕鋅板,產生的廢液稱“爛板液”。“爛板液”中含硝酸鋅外,還含有自來水帶入的Cl—和Fe3+。在實驗室里,用“爛板液”制取ZnSO4·7H2O的過程如下: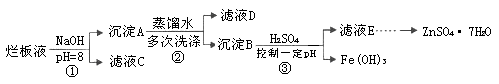
(1)若稀硝酸腐蝕鋅板時還原產物為N2O,氧化劑與還原劑的物質的量之比是 。
(2)若步驟①的pH>12,則Zn(OH)2溶解生成四羥基合鋅酸鈉。寫出Zn(OH)2被溶解的離子方程式 。
(3)濾液D中除了含有OH—離子外,還含有的陰離子有 (填離子符號)。
(4)若濾液E的pH=4,c(Zn2+)=2mol·L-1,c(Fe3+)=2.6×l0-9mol·L-1,能求得的溶度積是 (填選項)。
A.Ksp[Zn(OH)2] B.Ksp[Zn(OH)2]和Ksp[Fe(OH)3] C.Ksp[Fe(OH)3]
(5)步驟③要控制pH在一定范圍。實驗室用pH試紙測定溶液pH的方法是: 。
(6)已知:①Fe(OH)3(s) Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1
Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1
②H2O(l)  H+(aq)+OH-(aq) ;ΔH=" b" kJ?mol-1
H+(aq)+OH-(aq) ;ΔH=" b" kJ?mol-1
請寫出Fe3+發生水解反應的熱化學方程式: 。
若①的溶度積常數為KSP,②的離子積常數為KW,Fe3+發生水解反應的平衡常數:
K= 。(用含KSP、KW的代數式表示)
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
工業上用電解飽和NaCl溶液的方法來制取NaOH、Cl2和H2,并以它們為原料生產一系列化工產品,稱為氯堿工業。
(1)若采用無隔膜法電解冷的食鹽水時,Cl2會與NaOH充分接觸,導致產物僅是NaClO和H2。無隔膜法電解冷的食鹽水相應的離子方程式為 。
(2)氯堿工業耗能高,一種將電解池與燃料電池相組合的新工藝可以節(電)能30%以上。在這種工藝設計中,相關物料的傳輸與轉化關系如下圖所示,其中的電極未標出,所用的離子膜都只允許陽離子通過。
①經精制的飽和NaCl溶液應從圖中電解池的 (填寫“左” 或“右”)池注入。
②圖中X是____ __(填化學式);乙中右室的電極反應式為: _ ,圖示中氫氧化鈉溶液質量分數a%與b%的關系是 (填字母)。
A. a%=b% B. a%﹥b% C. a%﹤b%
③甲中的離子交換膜為 (填“陽離子交換膜”或“陰離子交換膜”)。
(3)氯堿工業的產物NaOH與不同物質反應可以生成不同的鹽。已知常溫下,濃度均為0.1 mol/L的4種鈉鹽溶液pH如下表:
| 溶質 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)常溫下某強酸溶液pH=a,強堿溶液pH=b,已知a+b=12,酸堿溶液混合pH=7,則酸溶液體積V(酸)和堿溶液體積V(堿)的比值關系為 。
(2)現有濃度均為0.1 mol/L的下列溶液:①氫氧化鋇;②醋酸;③氫氧化鈉;④鹽酸,四種溶液中由水電離出的OH—濃度由大到小的順序是(填序號) 。
(3)已知100℃ KW=10-12,若將此溫度下pH=8的Ba(OH)2溶液與pH=5的稀鹽酸混合,并保持100℃的恒溫,欲使混合溶液pH=7,則Ba(OH)2溶液與鹽酸的體積之比為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
A、B、C、D、E五種溶液分別是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一種。常溫下進行下列實驗:
①將1 L pH=3的A溶液分別與0.001mol·L-1 xL B溶液、0.001mol·L-1 yL D溶液充分反應至中性,x、y大小關系為:y<x;②濃度均為0.1mol·L-1A和E溶液,pH:A<E;③濃度均為0.1mol·L-1C與D溶液等體積混合,溶液呈酸性。
回答下列問題:
(1)D是 溶液,判斷理由是 。
(2)用水稀釋0.1 mol·L-1B時,溶液中隨著水量的增加而減小的是 (填寫序號)。
①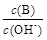 ②
②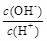 ③c(H+)和c(OH-)的乘積 ④OH-的物質的量
③c(H+)和c(OH-)的乘積 ④OH-的物質的量
(3)OH-濃度相同的等體積的兩份溶液A和E,分別與鋅粉反應,若最后僅有一份溶液中存在鋅粉,且放出氫氣的質量相同,則下列說法正確的是________(填寫序號)。
①反應所需要的時間E>A ②開始反應時的速率A>E
③參加反應的鋅粉物質的量A=E ④反應過程的平均速率E>A
⑤A溶液里有鋅粉剩余 ⑥E溶液里有鋅粉剩余
(4)將等體積、等物質的量濃度B和C混合后溶液,升高溫度(溶質不會分解)溶液pH隨溫度變化如右圖中的_________曲線(填寫序號) 。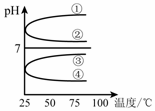
(5)室溫下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有離子的物質的量濃度由大到小的順序為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
硫酸是強酸,中學階段將硫酸在水溶液中看作完全電離。但事實是,硫酸在水中的第一步電離是完全的,第二步電離并不完全,其電離情況為:H2SO4=H++HSO4-,HSO4- H++SO42-.
H++SO42-.
請據此回答下列有關問題:
(1)Na2SO4溶液呈 (填“弱酸性”、“中性”或“弱堿性”),原因是: (用離子方程式表示)
(2)寫出H2SO4溶液與BaCl2溶液反應的離子方程式: ;
(3)在0.1 mol·L-1的Na2SO4溶液中,下列粒子濃度關系式正確的是 。(填編號)
| A.c(SO42-)+c(HSO4-)=0.1 mol·L-1 | B.c(SO42-)+c(HSO4-)=2 c(Na+) |
| C.c(OH-)=c(H+)+c(HSO4-) | D.c(Na+)+c(H+)=c(OH-)+c(HSO4-) |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
水體中重金屬鉛的污染問題備受關注。水溶液中鉛的存在形態主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形態的濃度分數α隨溶液pH變化的關系如下圖所示: 
(1)Pb(NO3)2溶液中, ________2(填“>”“=”或“<”);往該溶液中滴入氯化銨溶液后,
________2(填“>”“=”或“<”);往該溶液中滴入氯化銨溶液后, 增加,可能的原因是________________________________。
增加,可能的原因是________________________________。
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8時溶液中存在的陽離子(Na+除外)有__________,pH=9時主要反應的離子方程式為_______________________。
(3)某課題組制備了一種新型脫鉛劑,能有效去除水中的痕量鉛,實驗結果如下表:
| 離子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 處理前濃度/(mg·L-1) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 處理后濃度/(mg·L-1) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
 E2Pb(s)+2H+則脫鉛的最合適pH范圍為( )
E2Pb(s)+2H+則脫鉛的最合適pH范圍為( )查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(15分)
制燒堿所用鹽水需兩次精制。第一次精制主要是用沉淀法除去粗鹽水中Ca2+、Mg2+、Fe3+、SO42-等離子,過程如下:
Ⅰ. 向粗鹽水中加入過量BaCl2溶液,過濾;
Ⅱ. 向所得濾液中加入過量Na2CO3溶液,過濾;
Ⅲ. 濾液用鹽酸調節pH,獲得一次精制鹽水。
(1)過程Ⅰ除去的離子是______。
(2)過程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com