光氣(COCl
2)在塑料、制革、制藥等工業中有許多用途,工業上采用CO與Cl
2在活性炭催化下合成.
(1)實驗室中常用來制備氯氣的化學方程式為
MnO
2+4HCl(濃)
MnCl
2+Cl
2↑+2H
2O
MnO
2+4HCl(濃)
MnCl
2+Cl
2↑+2H
2O
;
(2)工業上利用天然氣(主要成分為CH
4)與CO
2進行高溫重整制備CO,已知CH
4、H
2和CO的燃燒熱(△H)分別為-890.3kJ?mol
-1、-285.8kJ?mol
-1、-283.0kJ?mol
-1,則生成1m
3(標準狀況)CO所需熱量為
5.52×103KJ
5.52×103KJ
;
(3)實驗室中可用氯仿(CHCl
3)與雙氧水直接反應制備光氣,其反應的化學方程式為
CHCl3+H2O2=HCl+H2O+COCl2
CHCl3+H2O2=HCl+H2O+COCl2
;
(4)COCl
2的分解反應為COCl
2(g)=Cl
2(g)+CO(g)△H=+108kJ?mol
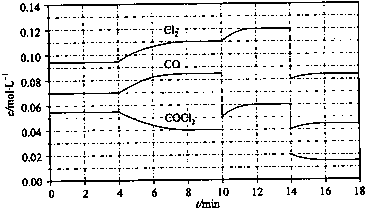
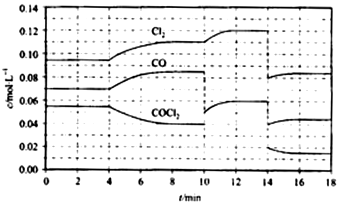
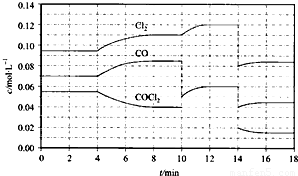
-1.反應體系達到平衡后,各物質的濃度在不同條件下的變化狀況如圖所示(第10min到14min的濃度變化曲線未示出):

①計算反應在第8min時的平衡常數K=
0.234mol?L-1
0.234mol?L-1
;
②比較第2min反應溫度T(2)與第8min反應溫度T(8)的高低:T(2)
<
<
T(8)(填“>”、“<”或“=”)
③若12min時反應于T(8)下重新達到平衡,則此時c(COCl
2)=
0.031
0.031
mol?L
-1④比較產物CO在2~3min、5~6min、12~13min時平均反應速率[平均反應速率分別以v(2~3)、v(5~6)、v(12~13)表示]的大小
v(5~6)>v(2~3)=v(12~13)
v(5~6)>v(2~3)=v(12~13)
;
⑤比較反應物COCl
2在5~6min、15~16min時平均反應速率的大小:v(5~6)
>
>
v(15~16)(填“>”、“<”或“=”),原因是
在相同溫度時,該反應的反應物的濃度越高,反應速率越大
在相同溫度時,該反應的反應物的濃度越高,反應速率越大
.