
 已知固體A的焰色反應呈黃色,D、G常溫下呈氣態,化合物E為淡黃色固體粉末,A、B、C、D、E、F、G有如圖轉化關系:
已知固體A的焰色反應呈黃色,D、G常溫下呈氣態,化合物E為淡黃色固體粉末,A、B、C、D、E、F、G有如圖轉化關系: Na2CO3+CO2↑+H2O,碳酸氫鈉和氫氧化鈉混合,反應實質是HCO3-+OH-=CO32-+H2O,
Na2CO3+CO2↑+H2O,碳酸氫鈉和氫氧化鈉混合,反應實質是HCO3-+OH-=CO32-+H2O, Na2CO3+CO2↑+H2O;HCO3-+OH-=CO32-+H2O;
Na2CO3+CO2↑+H2O;HCO3-+OH-=CO32-+H2O;

科目:高中化學 來源: 題型:
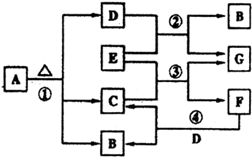 已知固體A的焰色反應呈黃色,D、G常溫下呈氣態,化合物E為淡黃色固體粉末,A、B、C、D、E、F、G有如圖轉化關系:
已知固體A的焰色反應呈黃色,D、G常溫下呈氣態,化合物E為淡黃色固體粉末,A、B、C、D、E、F、G有如圖轉化關系:
| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
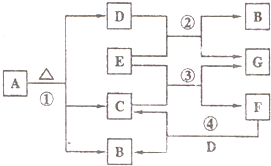 已知固體A的焰色反應呈黃色、D、G在常溫下呈氣態,化合物E為淡黃色固體粉末,A、B、C、D、E、F、G有如圖轉化關系.
已知固體A的焰色反應呈黃色、D、G在常溫下呈氣態,化合物E為淡黃色固體粉末,A、B、C、D、E、F、G有如圖轉化關系. 查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
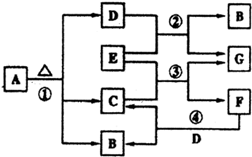
查看答案和解析>>
科目:高中化學 來源:2009-2010學年四川省宜賓一中高一(上)期末化學復習卷(解析版) 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com