
下列關(guān)于電解質(zhì)溶液的敘述正確的是
| A.常溫下,Na2CO3溶液的pH>7 |
| B.0.1mol/L Na2CO3溶液在35℃時(shí)堿性比25℃強(qiáng),說(shuō)明該水解反應(yīng)是是放熱反應(yīng) |
| C.常溫下.pH=7的NH4Cl與氨水的混合溶液中各離子濃度的關(guān)系為: c(Cl-)=c(NH4+)>c(H+)=c(OH一) |
| D.常溫下,中和pH與體積均相同的鹽酸和醋酸,消耗NaOH的物質(zhì)的量相同 |
AC
解析試題分析:A、由于CO32-發(fā)生水解:CO32—+H2O HCO3—+OH—,溶液顯堿性,正確;B、說(shuō)明水解是吸熱的,錯(cuò)誤;C、NH4Cl完全電離為NH4+和Cl-,加少量的氨水抑制NH4+的水解,由電荷守恒式: c(NH4+)+c(H+)=c(OH一) +c(Cl-)變形可得:c(Cl-)=c(NH4+)>c(H+)=c(OH一),正確;D、醋酸是弱酸,部分電離,pH相同的鹽酸與醋酸中是醋酸濃度遠(yuǎn)大于鹽酸,體積相同時(shí)消耗NaOH是醋酸遠(yuǎn)大于鹽酸,錯(cuò)誤。
HCO3—+OH—,溶液顯堿性,正確;B、說(shuō)明水解是吸熱的,錯(cuò)誤;C、NH4Cl完全電離為NH4+和Cl-,加少量的氨水抑制NH4+的水解,由電荷守恒式: c(NH4+)+c(H+)=c(OH一) +c(Cl-)變形可得:c(Cl-)=c(NH4+)>c(H+)=c(OH一),正確;D、醋酸是弱酸,部分電離,pH相同的鹽酸與醋酸中是醋酸濃度遠(yuǎn)大于鹽酸,體積相同時(shí)消耗NaOH是醋酸遠(yuǎn)大于鹽酸,錯(cuò)誤。
考點(diǎn):考查溶液中的離子平衡,具體涉及:水解顯堿性、水解吸熱、離子濃度大小比較、酸堿中和消耗用量問(wèn)題。


 浙江名校名師金卷系列答案
浙江名校名師金卷系列答案
| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來(lái)源: 題型:單選題
常溫下,取0.3 mol/L HY溶液與0.3 mol/L NaOH溶液等體積混合(不計(jì)混合后溶液體積變化),測(cè)得混合溶液的pH=9,則下列說(shuō)法(或關(guān)系式)正確的是
| A.混合溶液中由水電離出來(lái)的c(OH-)=1×10-9 mol/L |
| B.混合溶液中離子濃度大小次序?yàn)椋篶(Y-)>c(Na+)>c(OH-)>c(H+) |
| C.c(OH-)=c(HY)=c(H+)=1×10-9 mol/L |
| D.c(Na+)=c(Y-)+c(HY)="0.3" mol/L |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:單選題
下列敘述正確的是(設(shè)NA為阿伏加德羅常數(shù)的數(shù)值)
| A.檢驗(yàn)溶液中是否含有Fe2+的方法是先滴加氯水,再滴加KSCN溶液 |
| B.鉛蓄電池放電時(shí)的負(fù)極反應(yīng)式為:PbO2+4H++SO42一+2e一=PbSO4+2H2O |
| C.Na2CO3溶液加水稀釋后,恢復(fù)至原溫度,溶液的pH和Kw均減小 |
| D.某電池的總反應(yīng)為:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,每生成lmolNa2Mn5O10轉(zhuǎn)移電子數(shù)2NA |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:單選題
下列敘述錯(cuò)誤的是 ( )
| A.把a(bǔ) L 0.1 mol/L 的CH3COOH溶液與b L 0.1 mol/L的 KOH溶液混合,所得溶 液中一定存在:c (K+)+ c (H+) =" c" (CH3COO-) + c (OH-) |
| B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| C.把0.1 mol/L 的NaHCO3溶液與0.3 mol/L 的Ba(OH)2溶液等體積混合,所得溶 液中一定存在:c (OH-) >c (Ba2+)>c (Na+)> c (H+) |
| D.常溫下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的電離程度相同 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:單選題
下列敘述正確的是
A.已知I3- I2+I(xiàn)-,向盛有KI3溶液的試管中加入適量CCl4,振蕩?kù)o置后CCl4層顯紫紅色,說(shuō)明KI3在CCl4中的溶解度比在水中的大 I2+I(xiàn)-,向盛有KI3溶液的試管中加入適量CCl4,振蕩?kù)o置后CCl4層顯紫紅色,說(shuō)明KI3在CCl4中的溶解度比在水中的大 |
B.室溫下向10mL pH =3的醋酸溶液中加水稀釋后,溶液中 減小 減小 |
| C.室溫時(shí)ka(HF)=3.6×10-4,ka(CH3COOH)=1.75×10-5,0.1 mol /L的NaF溶液與0.1 mol /L的CH3COOK溶液相比,一定有c(Na+) -c(F-)<c(K+)-c(CH3COO-)成立 |
D.在25℃時(shí),將amol/L的氨水與0.01 mol/L的鹽酸等體積混合,充分反應(yīng)后溶液中c(NH4+)=c(Cl-),則25℃時(shí)NH3 ? H2O的電離常數(shù)Kb=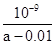 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:單選題
下列有關(guān)物質(zhì)濃度關(guān)系的描述中,正確的是
| A.25℃時(shí),NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol·L-1 |
| B.25℃時(shí),向0.1mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性: c(Na+)>c(NH4+)>c(SO42—)>c(OH—)=c(H+) |
| C.0.1mol·L-1的NaHCO3溶液中:c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) |
| D.同溫下,pH相同時(shí),溶液物質(zhì)的量濃度: |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:單選題
25℃時(shí),有關(guān)弱酸的電離平衡常數(shù)如下,下列有關(guān)說(shuō)法正確的是
| 弱酸化學(xué)式 | CH3COOH | HCN | H2CO3 |
| 電離平衡常數(shù)(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:單選題
下列溶液中各微粒的濃度關(guān)系不正確的是
| A.0.1 mol/LCH3COOH溶液中:c(CH3COO-)+ c(CH3COOH)=0.1mol/L |
| B.NaHCO3溶液中: c(OH-) = c(H+) + c(H2CO3)-c(CO32-) |
| C.CH3COONa溶液中:c(Na+)> c(CH3COO-)> c(OH-)> c(H+) |
| D.Na2S溶液中:2 c(Na+)= c(S2-) + c(HS-)+ c(H2S) |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:單選題
常溫下,下列敘述錯(cuò)誤的是
A.向0.1mol·L-1的醋酸溶液中加水或通入HCl氣體都能使 值增大 值增大 |
| B.0.1mol·L-1的醋酸鈉溶液20mL與0.1mol·L-1鹽酸10mL混合后溶液顯酸性,則有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) |
| C.pH=4的醋酸與pH=10的氫氧化鈉溶液等體積混合,所得溶液pH<7 |
D.0.1mol·L-1某一元酸HA溶液中 =1×10-8,則該溶液中由水電離出的c(H+)=1×10-11mol/L =1×10-8,則該溶液中由水電離出的c(H+)=1×10-11mol/L |
查看答案和解析>>
國(guó)際學(xué)校優(yōu)選 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專(zhuān)區(qū) | 電信詐騙舉報(bào)專(zhuān)區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專(zhuān)區(qū) | 涉企侵權(quán)舉報(bào)專(zhuān)區(qū)
違法和不良信息舉報(bào)電話(huà):027-86699610 舉報(bào)郵箱:58377363@163.com