
【題目】捕集、利用CO2是人類可持續發展的重要戰略之一。
(1)用太陽能工藝捕獲CO2可得炭黑,其流程如圖所示:

①捕獲1mo1CO2轉移電子的物質的量是_________。
②過程2反應的化學方程式是________。
(2)將CO2催化加氫可合成低碳烯烴:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g),按投料比n(CO2):n(H2)=1:3將CO2與H2充入密閉容器,在0.1MPa時,測得平衡時四種氣態物質,其溫度(T)與物質的量(n)的關系如圖所示。
C2H4(g)+4H2O(g),按投料比n(CO2):n(H2)=1:3將CO2與H2充入密閉容器,在0.1MPa時,測得平衡時四種氣態物質,其溫度(T)與物質的量(n)的關系如圖所示。

①正反應的焓變△H_________0。
②提高CO2的轉化率,可采用的方法是______。
a.增大n(CO2)與n(H2)的投料比
b.改變催化劑
c.縮小容器體積
③圖中表示水的曲線是_____。
(3)電解CO2可制得多種燃料:下圖是在酸性電解質溶液中,以惰性材料做電極將CO2轉化為丙烯的原理模型。

①太陽能電池的正極是________。
②生成丙烯的電極反應式是___________。
【答案】 4mol 6FeO + CO2 = 2Fe3O4 + C < c b b 3CO2 + 18H+ + 18e- = CH2=CH-CH3 + 6H2O
【解析】(1)①從圖中流程來看CO2~C~4mole-,故捕獲1molCO2轉移電子的物質的量是4mol;②過程2是FeO和CO2反應生成Fe3O4和C,故化學方程式為6FeO+CO2=2Fe3O4+C;(2)①由曲線變化可知隨著溫度升高,氫氣的物質的量逐漸增多,說明升高溫度平衡逆向移動,則正反應放熱,△H<0;②為提高CO2的平衡轉化率,除改變溫度外,還可采取的措施是增大壓強或者減少n(CO2)與n(H2)的投料比,都能使平衡向正反應方向進行,催化劑不能改變平衡狀態,答案選c;③隨著溫度升高,氫氣的物質的量逐漸增多,因氫氣為反應物,則另一條逐漸增多的曲線為CO2,由計量數關系可知b為水,c為C2H4的變化曲線;(3)①右側電極產生氧氣,說明是陽極,氫氧根放電,因此太陽能電池的正極是b;②電解時,二氧化碳在陰極上得到電子生成丙烯,電極反應式為3CO2+18H++18e-=CH3-CH=CH2+6H2O。


 口算題卡加應用題集訓系列答案
口算題卡加應用題集訓系列答案 綜合自測系列答案
綜合自測系列答案科目:高中化學 來源: 題型:
【題目】下列關于化學鍵的敘述中,正確的是( )
A.離子化合物中可能含有共價鍵B.氫鍵是一種特殊的共價鍵
C.I2的升華破壞了共價鍵D.非金屬元素間不可能形成離子鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】具有下列電子排布式的原子中,半徑最大的是( )
A. 1s22s22p63s23p5 B. 1s22s22p3
C. 1s22s22p2 D. 1s22s22p63s23p4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,Ka (HCOOH)=1.77×10-4,Ka (CH3COOH)=1.75×10-5,Kb (NH3·H2O) =1.76×10-5,下列說法正確的是( )
A. 將CH3COONa溶液從20℃升溫至30℃,溶液中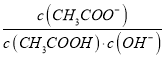 增大
增大
B. 用相同濃度的NaOH溶液分別滴定等體積pH均為3的HCOOH和CH3COOH溶液至終點,消耗NaOH溶液的體積相等
C. 0.2 mol/L HCOOH 與 0.1 mol/L NaOH 等體積混合后:c(HCOO-) + c(OH-) = c(HCOOH) + c(H+)
D. 0.2 mol/L CH3COONa 與 0.1 mol/L鹽酸等體積混合后 (pH<7):c(CH3COO-) > c(Cl- ) >c(CH3COOH) >c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室欲配制0.5 mol/L的NaOH溶液500 mL:
(1)主要操作步驟的正確順序是__________________________(填序號)。
①稱取一定質量的氫氧化鈉,放入燒杯中,用適量蒸餾水溶解;②用膠頭滴管向容量瓶中加入蒸餾水至凹液面與刻度線相切;③待冷卻至室溫后,將溶液轉移到500mL容量瓶中;④蓋好瓶塞,反復上下顛倒,搖勻;⑤用少量的蒸餾水洗滌燒杯內壁和玻璃棒2~3次,洗滌液轉移到容量瓶中。
(2)某同學欲稱量NaOH的質量,他先用托盤天平稱量燒杯的質量,天平平衡后的狀態如圖.由圖中可以看出,該同學在操作時的一個錯誤是______________________________,燒杯的實際質量為_______________克。

(3)使用容量瓶前必須進行的一步操作是__________________________________。
(4)在配制過程中,其他操作都正確的,下列操作會引起誤差偏高的是_______________
①沒有洗滌燒杯和玻璃棒
②轉移溶液時不慎有少量灑到容量瓶外面
③容量瓶不干燥,含有少量蒸餾水
④定容時俯視標線
⑤定容時仰視標線
⑥定容后塞上瓶塞反復搖勻,靜置后,液面低于刻度線,再加水至刻度線。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】抗結腸炎藥物有效成分M的合成路線如下(部分反應略去試劑和條件):
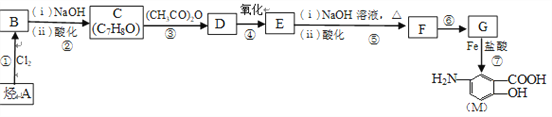
已知:
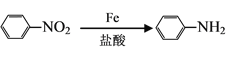
(1)烴A的結構簡式是__________,G中的官能團名稱是__________。
(2)反應①的反應條件是_________,反應⑥的反應類型是__________。
(3)下列對抗結腸炎藥物有效成分M可能具有的性質推測正確的是________(填字母)。
A.既有酸性又有堿性 B.能發生消去反應
C.能發生加聚反應 D.1mol M與足量溴水充分反應,最多消耗1molBr2
(4)E與足量NaOH溶液反應的化學方程式是_______________________。
(5)寫出符合下列條件的D的同分異構體的結構簡式(任寫一種)__________。
①屬于芳香族化合物且苯環上有3個取代基
②能和NaHCO3溶液反應產生氣體
③核磁共振氫譜有4組峰且峰面積之比為6∶2∶1∶1
(6)M在一定條件下可以發生縮聚反應生成含肽鍵的高分子化合物,寫出該反應的化學方程式:_______________________________________________________
(7)已知:①![]() 易被氧化,②苯環上連有烷基時再引入一個取代基,常取代在烷基的鄰對位。③苯環上連有羧基時再引入一個取代基,常取代在羧基的間位。參照以上的合成路線,設計一條以A為原料合成化合物
易被氧化,②苯環上連有烷基時再引入一個取代基,常取代在烷基的鄰對位。③苯環上連有羧基時再引入一個取代基,常取代在羧基的間位。參照以上的合成路線,設計一條以A為原料合成化合物![]() 的合成路線。_______
的合成路線。_______
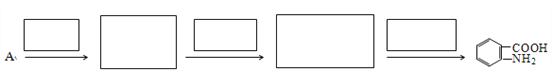
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列是幾種原子的基態電子排布,電負性最大的原子是
A. 1s22s22p4 B. 1s22s22p63s23p3 C. 1s22s22p63s23p2 D. 1s22s22p63s23p64s2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學需要配制450 mL 0.5 mol·L-1的NaOH溶液。請回答下列問題:
(1)在實驗過程中用到的玻璃儀器有:玻璃棒、量筒、燒杯、______________、膠頭滴管、試劑瓶。
(2)用托盤天平稱量時,應將NaOH放在________稱量,稱取的固體質量為_______。
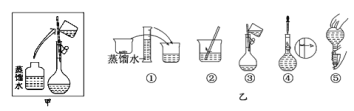
(3)配制時操作步驟如乙圖所示,則甲圖操作應在乙圖中的___(填選項字母)之間。
A.①與② B.②與③ C.③與④ D.④與⑤
(4)配制過程中洗滌燒杯、玻璃棒2~3次的目的是______________________。
(5)定容滴加蒸餾水時,若不慎超過了刻度線,則處理的方法是______________。
(6)該同學實際配制NaOH溶液的濃度為0.6 mol·L-1,原因可能是____(填序號)。
a.砝碼上有雜質
b.洗凈的容量瓶中殘留有少量水
c.稱量NaOH固體時,采用了“左碼右物”
d.定容時俯視刻度線
e.定容搖勻后發現液面低于刻度線又加入少許水調至刻度線
f.溶解固體的燒杯移液后未洗滌
g.定容前溶液未進行冷卻
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)配平下列方程式
①___FeCl3 +___KI===____FeCl2+____KCl+_____I2
②____ClO-+_____Fe(OH)3+_____OH-===_____Cl-+____FeO![]() +____H2O
+____H2O
(2)用濃硫酸配制稀硫酸的過程中,下列操作會使配制的稀硫酸溶液濃度偏高的是___(填序號)。
①量取濃硫酸的量筒用蒸餾水洗滌2~3次,并把洗滌液轉入容量瓶
②容量瓶使用時未干燥
③溶解后未經冷卻就移液并定容
④定容時不小心有少量蒸餾水滴到瓶外
⑤定容后經振蕩、搖勻、靜置,發現液面低于刻度線,再加蒸餾水補至刻度線
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com