
ClO2作為消毒劑在消毒過程中對人體無毒無害,具有廣泛的應用前景。某同學用下圖所示的裝置制備ClO2氣體,反應原理為飽和草酸溶液與KClO3粉末在60℃時反應制得ClO2(溫度過高或過低都會影響制氣效率)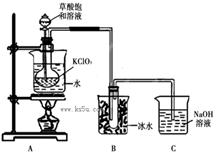
已知信息:①ClO2是一種黃綠色有刺激性氣味的氣體,熔點-59℃,沸點11.0℃。與堿反應和氯氣相似。
②草酸是酸性強于醋酸的二元弱酸,對應的鈣鹽(CaC2O4)不溶于醋酸,能溶于強酸,它還是一種還原性較強的物質。
(1)制備ClO2的化學方程式:2KClO3+H2C2O4= 2KHCO3+2ClO2↑;下列說法正確的是
| A.KClO3在反應中得到電子 |
| B.ClO2是氧化產物 |
| C.H2C2O4在反應中失去電子 |
| D.1mol KClO3參加反應有2mol電子轉移 |
(1)AC(2)溫度計;不可以,若直接加熱溫度難以控制。(3)ClO2揮發,進入C中,與氫氧化鈉溶液反應。2ClO2+2NaOH= NaClO2 +NaClO3+H2O
(4)2KClO3+H2C2O4+H2SO4= 2ClO2↑+K2 SO4+2CO2↑+2H2O3.01×1023 (或0.5NA)
解析試題分析:(1)反應2KClO3+H2C2O4= 2KHCO3+2ClO2↑中,Cl元素的化合價由+5價降低為+4價,C元素的化合價由+3價升高到+4價,A、KClO3中Cl元素的化合價由+5價降低為+4價,則在反應中得到電子,正確;B、KClO3中Cl元素的化合價由+5價降低為+4價,被還原生成ClO2,ClO2為還原產物,錯誤;C、H2C2O4中C元素的化合價由+3價升高到+4價,草酸為還原劑,正確;D、1molKClO3參加反應轉移電子為1mol,錯誤。(2)制備ClO2氣體的反應原理為飽和草酸溶液與KClO3粉末在60℃時反應制得ClO2,必須控制溫度在60℃,采用水浴加熱,應用溫度計則水溫;(3)由信息①知ClO2的沸點11.0℃,易揮發,與堿反應和氯氣相似可得:2ClO2+2NaOH= NaClO2 +NaClO3+H2O(4)利用化合價升降法配平氧化還原方程式;KClO3中Cl元素的化合價由+5價降低為+4價,1mol KClO3參加反應轉移電子為1mol,0.5 mol KClO3參加反應有0.5NA個電子轉移。
考點:考查氧化還原反應基本概念,化學方程式的書寫及有關實驗。


 名師指導期末沖刺卷系列答案
名師指導期末沖刺卷系列答案科目:高中化學 來源: 題型:實驗題
請分析回答某同學在探究濃硫酸、稀硫酸、濃硝酸、稀硝酸分別與銅反應的實驗中發現的有關問題。
Ⅰ.探究上述四種酸的氧化性相對強弱及其與銅反應的還原產物的性質
(1)分別向盛有等量銅片的四支試管中加入等體積的濃硫酸、稀硫酸、濃硝酸、稀硝酸,實驗結果記錄如下表:
| | 酸 | 實驗結果 |
| a | 濃硫酸 | 加熱后發生反應,產生無色刺激性氣體 |
| b | 稀硫酸 | 加熱也不發生反應 |
| c | 濃硝酸 | 不加熱即發生反應,產生紅棕色氣體 |
| d | 稀硝酸 | 微熱發生反應,產生無色氣體 |


查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
某同學用下面的裝置制備并收集純凈的氯化鐵,硬質玻璃管E中裝有細鐵絲網。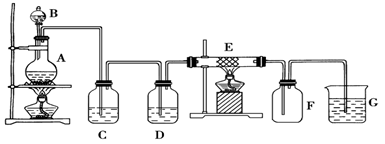
試回答:
(1)檢驗裝置A的氣密性的方法是
(2)裝置A中反應的化學方程式為
(3)裝置C的作用是: ________________,裝置D中的試劑是:____ _______。
(4)可檢驗裝置E中生成的物質中陽離子的方法及現象是 。
(5)若把氯氣通入石蕊溶液中,觀察的現象是: 。
(6)裝置 G中發生反應的離子方程式為:________________ _ ____________。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
Ⅰ、 (1)某化學興趣小組欲從下列裝置中選取必要的裝置制取 (NH4)2SO4溶液,連接的順序(用接口序號字母表示)是:a 
(2)將裝置C中兩種液體分離開的操作名稱是__ _______。
裝置D的作用是 。
Ⅱ、(4分)為提高氯化銨的經濟價值,我國化學家設計了利用氫氧化鎂熱分解氯化銨制氨氣并得到堿式氯化鎂(MgOHCl)的工藝。某同學根據該原理設計的實驗裝置如圖:
請回答下列問題:
(1) 裝置A中發生反應生成堿式氯化鎂的化學方程式為_________ ____
裝置B中堿石灰的作用是_____ __
(2) 反應過程中持續通入N2的作用有兩點:一是使反應產生的氨氣完全導出并被稀硫酸充分吸收,二是_______________ ______
(3) 裝置C的試管中反應的離子方程式為 ______________
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
如圖是制取無水氯化銅的實驗裝置圖,將濃鹽酸滴加到盛有二氧化錳粉末的圓底燒瓶中。請回答下列問題: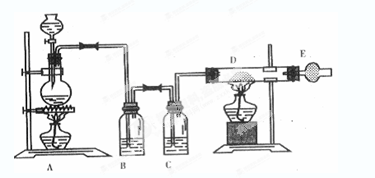
(1)盛放濃鹽酸的儀器名稱為____;
(2)燒瓶中發生反應的化學方程式 ;
(3)C瓶中的試劑是____;其作用是____;
(4)玻璃管D中發生反應的化學方程式 ;反應現象是___;
(5)干燥管E中盛有堿石灰(CaO+NaOH),其作用是____。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
長期存放的亞硫酸鈉可能會被空氣中的氧氣氧化。某化學興趣小組通過實驗來測定亞硫酸鈉試劑被氧化的程度,設計了下圖實驗,請回答下面的問題: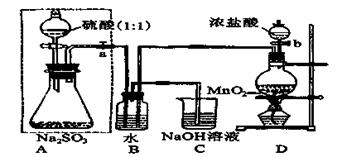
(1)D裝置中反應的化學方程式為 。
B裝置中反應的離子方程為 。
(2)稱量ag Na2SO3樣品放入錐形瓶中,向B裝置反應后的溶液中加入足量的BaCl2溶液充分反應、過濾、洗滌、干燥,得白色沉淀bg,原樣品中Na2SO3的質量分為數為: 。
(3)為保證實驗測定的準確性,A中的硫酸什么時候滴加 ,
C裝置中NaOH溶液的作用是 _________________。
(4)現有以下試劑:①蒸餾水、②稀鹽酸、③稀硝酸、④BaCl2溶液、⑤Ba(NO3)2溶液,請從中選擇合適試劑,設計一種不同的實驗方法,測定試樣中無水亞硫酸鈉被氧化的程度,你使用試劑的順序為: 。(填試劑編號)
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
四氯化錫常溫下是無色液體,在空氣中極易水解,熔點-36℃,沸點114℃,金屬錫的熔點為231℃。裝置A中放濃鹽硫,B中放MnO2,二者用于制氯氣,用熔融的金屬錫跟干燥的氯氣直接作用制取無水四氯化錫(此反應過程放出大量的熱)。請回答下列各問題。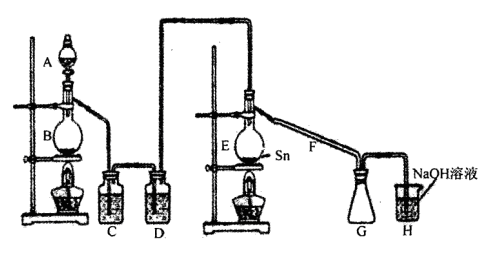
(1).上圖中氣體發生和尾氣處理裝置不夠完善,請你提出改進意見_______________________________。
利用改進后的正確裝置進行實驗,請回答下列問題:
(2)H中反應的離子方程式:_________________________________________________;
E中反應的化學方程式:________________________________________________。
(3)C、D中的試劑分別是_______________、____________________。
(4)儀器A、B的名稱分別是_____________、____________,F的作用是_____________。
(5)實驗時應先點燃_________處酒精燈,加熱溫度應大于________ ℃,待________,即可停止加熱。
(6)已知四氯化錫遇水強烈水解,產物之一是固態二氧化錫,那么四氯化錫水解的化學方程式為________________________________________________________________。
(7)如果將制取的四氯化錫少許暴露于空氣中,預期可看到的現象是___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
已知Na2SO3固體與硫酸可發生反應:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑,下圖是實驗室制取SO2并驗證SO2的某些性質的裝置圖。試回答: [
[
(1)①中的實驗現象為紫色石蕊試液_________________,此實驗證明SO2是________氣體。
(2)②中的品紅溶液___________________,證明SO2有__________性。
(3)③中的實驗現象是_________________,證明SO2有__________性。
(4)④中的實驗現象是_________________,證明SO2有__________性。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com