
【題目】已知:乙二酸俗稱草酸(結構簡式為HOOC-COOH,可簡寫為H2C2O4)。25℃時,草酸的電離平衡常數為K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3)的電離平衡常數為K1=4.5×10-7,K2=4.7×10-11。草酸鈣的Ksp=4.0×10-8,碳酸鈣的Ksp=2.5×10-9。回答下列問題:
(1)寫出水溶液中草酸的電離方程式_____________________________________ 。
(2)相同條件下物質的量濃度都為0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH______________ (填“大”、“小”或“相等”) 。
(3)常溫下將0.4mol/L的KOH溶液20mL與0.2mol/L的草酸溶液20mL混合,則混合后溶液中陰離子濃度的大小順序為_____________________________________ 。
(4)往Na2CO3溶液中加入少量草酸溶液,發生反應的離子方程式為________________。
(5)25℃時,向20mL碳酸鈣的飽和溶液中逐滴加入c mol/L的草酸鉀溶液20mL后,有草酸鈣沉淀生成,則c的最小值為__________________________。
【答案】 H2C2O4HC2O4-+H+、HC2O4-C2O42-+H+ 小 c(C2O42-)>c(OH-)>c(HC2O4-) 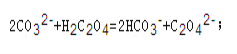 3.2×10-3
3.2×10-3
【解析】(1)酸是二元弱酸存在電離平衡,分步電離,以第一步為主,電離方程式為:H2C2O4![]() H++HC2O4-,HC2O4-
H++HC2O4-,HC2O4-![]() H++C2O42-;故答案為:H2C2O4
H++C2O42-;故答案為:H2C2O4![]() H++HC2O4-,HC2O4-
H++HC2O4-,HC2O4-![]() H++C2O42-;
H++C2O42-;
(2)依據電離平衡常數分析,酸性強弱順序為:草酸>碳酸>HC2O4->HCO3-,酸性越強,對應鹽的水解程度越弱,則相同條件下物質的量濃度都為0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH小;故答案為:小;
(3)常溫下,0.4mol/L的KOH溶液20mL與0.2mol/L的草酸溶液20mL恰好反應生成草酸鈉,醋酸根離子易水解而使其溶液呈堿性,但第一步水解大于第二步,兩步水解都生成氫氧根離子,所以溶液中陰離子濃度大小順序是
c(C2O42-)>c(OH-)>c(HC2O4-),故答案為:c(C2O42-)>c(OH-)>c(HC2O4-);
(4)電離平衡常數分析,酸性強弱順序為:草酸>碳酸>HC2O4->HCO3-;往Na2CO3溶液中加入少量草酸溶液反應生成碳酸氫鈉和草酸鈉,反應的離子方程式為:2CO32-+H2C2O4=2HCO3-+C2O42-;故答案為:2CO32-+H2C2O4=2HCO3-+C2O42-;
(5)25℃時,向20mL碳酸鈣的飽和溶液中逐滴加入c mol/L的草酸鉀溶液20mL后,有草酸鈣沉淀生成;碳酸鈣的Ksp=2.5×10-9=c(Ca2+)c(CO32-),飽和溶液中鈣離子濃度c(Ca2+)=5×10-5mol/L,等體積混合后溶液中c(Ca2+)=2.5×10-5mol/L,草酸鈣的Ksp=4.0×10-8 =c(Ca2+)c(C2O42-)=2.5×10-5mol/L×![]() mol/L,c=
mol/L,c=![]() =3.2×10-3mol/L,故答案為:3.2×10-3。
=3.2×10-3mol/L,故答案為:3.2×10-3。


 金鑰匙試卷系列答案
金鑰匙試卷系列答案科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
A.在雞蛋清溶液中加入飽和Na2SO4溶液時,會使蛋白質發生變性
B.纖維素在人體內的水解產物是葡萄糖
C.變質的油脂有難聞的特殊氣味,是由于油脂發生了水解反應
D.三大合成材料是指塑料、合成纖維和合成橡膠
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某些電鍍廠的酸性廢水中常含有一定量的CrO42-和Cr2O72-,它們會對人類及生態系統產生很大的傷害,必須進行處理。常用的處理方法有兩種。
方法1:還原沉淀法,該法的工藝流程為:
![]()
(1)其中第①步存在平衡:2CrO42-(黃色)+2H+![]() Cr2O72-(橙色)+H2O,若平衡體系的pH=12,該溶液顯_____色。能說明第①步反應達平衡狀態的是______。
Cr2O72-(橙色)+H2O,若平衡體系的pH=12,該溶液顯_____色。能說明第①步反應達平衡狀態的是______。
a.Cr2O72-和CrO42-的濃度相同 b.溶液的pH值不變
c.溶液的顏色不變 d.2v(Cr2O72-)=v(CrO42-)
(2)寫出第②步的離子反應方程式:__________。
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) ![]() Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常溫下,Cr(OH)3的溶度積Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH應調至_______。
方法2:電解法:該法用Fe做電極電解含Cr2O72-的酸性廢水,隨著電解進行,在陰極附近溶液pH升高,產生Cr(OH)3沉淀。
(4)寫出陽極的電極反應式___________________。
(5)在陰極附近溶液pH升高的原因是(用電極反應解釋)___________,溶液中同時生成的沉淀還有______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】滴定實驗在化學分析中有重要應用,現用濃度為0.1000molL-1酸性KMnO4標準溶液滴定未知濃度的草酸(H2C2O4):
(1)寫出滴定過程中發生反應的離子方程式為 _____________________________________ 。
(2)滴定過程中操作滴定管的圖示正確的是 _______________ 。
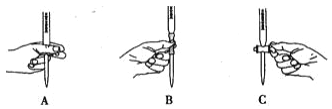
(3)若滴定時滴定管尖嘴部分有氣泡,滴定過程中消失,將導致測得的結果_____(選填:“偏大”、“偏小”或“不變”)。
(4)該滴定實驗滴定終點的現象是_____________________________________ 。
(5)Na2Cr2O7可用于測定廢水的化學耗氧量(即COD,指每升水樣中還原性物質被氧化所需要O2的質量)。現有某水樣100.00 mL,酸化后加入C1 mol/L的Na2Cr2O7溶液 V1 mL,使水中的還原性物質完全被氧化(Cr2O72-還原為Cr3+);再用C2mol/L的FeSO4溶液滴定剩余的Cr2O72-,結果消耗FeSO4溶液V2 mL。量取一定體積的Na2Cr2O7溶液時,需要用______(酸式或堿式)滴定管;該水樣的COD為___________________________mg/L;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某工廠對制革工業污泥中Cr元素的回收與再利用工藝如下(硫酸浸取液中的金屬離子主要是Cr3+,其次是Fe2+、Fe3+、Al3+、Cu2+、Mg2+)

常溫下部分陽離子以氫氧化物沉淀形式存在時溶液的pH見下表:
陽離子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
開始沉淀時的pH | 1.9 | 7.0 | 9.3 | 3.7 | 4.7 | --- |
沉淀完全時的pH | 3.2 | 9.0 | 11.1 | 8.0 | 6.7 | 9(>9 溶解) |
(1)酸浸時,為了提高浸取效率可采取的措施是____________________(至少寫一條)。
(2)加入H2O2 目的是氧化_______離子,其有關的離子方程式______________________。針鐵礦(Coethite)是以德國詩人歌德(Coethe)名字命名的,組成元素是Fe、H、O,化學式量為89,其化學式是______________。
(3)調pH=8是為了將_____________離子(從Fe3+、Al3+、Cu2+、Mg2+中選擇)以氫氧化物沉淀的形式除去。濾出的沉淀中部分沉淀將溶解于足量的氫氧化鈉溶液中,其有關的離子方程式是_____________________________________,取少量上層澄清溶液,向其中通入足量的CO2,又能重新得到相應的沉淀, 其有關的離子方程式為________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,體積和pH都相同的鹽酸和氯化銨溶液加水稀釋時的pH變化曲線如圖所示,下列判斷正確的是
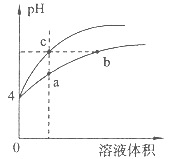
A. a、c兩點溶液的導電能力相同
B. b點溶液中c(H+)+c(NH3·H2O)=c(OH-)
C. a、b、c三點溶液中水的電離程度a>b>c
D. 用等濃度NaOH溶液和等體積b、c處溶液反應,消耗NaOH溶液體積Vb=Vc
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】痛風是關節炎反復發作及產生腎結石為特征的一類疾病,關節炎的原因歸結于在關節滑液中形成了尿酸鈉(NaUr)晶體,有關平衡如下:
① HUr(尿酸,aq) ![]() Ur-(尿酸根,aq)+H+(aq) (37℃時,Ka =4.0×10-6)
Ur-(尿酸根,aq)+H+(aq) (37℃時,Ka =4.0×10-6)
②NaUr(s) ![]() Ur-(aq)+Na+(aq)
Ur-(aq)+Na+(aq)
(1)37℃時,1.0L水中可溶解8.0×10-3mol尿酸鈉,此溫度下尿酸鈉的Ksp為________。
(2)關節炎發作大都在腳趾和手指的關節處,這說明溫度降低時,反應②的Ksp______(填“增大”、“減小”或“不變”),生成尿酸鈉晶體的反應是_______(填“放熱”或“吸熱”)反應。
(3)37℃時,某病人尿液中尿酸分子和尿酸根離子的總濃度為2.0×10-3mol/L,其中尿酸分子的濃度為5.0×10-4mol/L,該病人尿液的c(H+)為_________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com