
【題目】根據①~⑩元素的編號所在周期表中的位置,用化.學.用.語.回答有關問題:

(1)最難形成簡單離子的元素是____,元素⑧的最高價氧化物的水化物的化學式為_____;
(2)①與⑤能形成 9 電子微粒,其名稱為____;①與⑦可組成原子個數比為 1:1的化合物甲,將⑨的單質通入甲的水溶液中,生成一種強酸且有氣體放出,該反應的化學方程式為____;
(3)元素⑥、⑧形成的簡單氫化物中,沸點較高的是_____,原因是____;
(4)③與⑦的單質加熱條件下可發生反應,產物的化學式為____;
(5)元素④與鋁性質相似,其最高價氧化物的水化物能與⑩的氫氧化物反應,離子方程 式為________。
【答案】 He H3PO4 甲基 Cl2 + H2O2 = 2HCl + O2 NH3 氨氣分子間存在氫鍵 Li2O Be(OH)2 + 2OH—= BeO 2—+ 2H2O
【解析】結合元素周期表的結構可知,①為H元素、②為He元素、③為Li元素、④為Be元素、⑤為C元素、⑥為N元素、⑦為O元素、⑧為P元素、⑨為Cl元素、⑩為K元素;
(1)He是惰性元素,性質穩定,最難形成簡單離子,元素P的最高價為+5價,其最高價氧化物的水化物的化學式為H3PO4 ;
(2)H與C能形成 9 電子微粒—CH3,其名稱為甲基;H與O可組成原子個數比為 1:1的化合物為H2O2,將Cl2通入過氧化氫的水溶液中,生成一種強酸且有氣體放出,此氣體為O2,為氧化產物,則強酸應為HCl溶液,此反應的化學方程式為Cl2 + H2O2 = 2HCl + O2;
(3)NH3沸點高于PH3,是由于NH3分子間存在氫鍵的緣故;
(4)Li與O2在加熱條件下可發生反應,生成氧化鋰,其化學式為Li2O;
(5)Be與鋁性質相似,Be(OH)2有兩性,能與KOH溶液反應生成鹽和水,發生反應的離子方程 式為Be(OH)2 + 2OH—= BeO2—+ 2H2O。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】青蒿素是從黃花蒿中提取的一種無色針狀晶體,雙氫青蒿素是青蒿素的重要衍生物,抗瘧疾療效優于青蒿素,請回答下列問題:
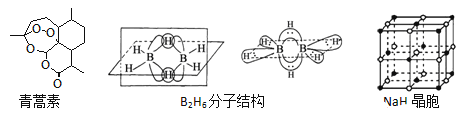
(1)組成青蒿素的三種元素電負性由大到小排序是__________,畫出基態O原子的價電子排布圖__________。
(2)一個青蒿素分子中含有_______個手性碳原子。
(3)雙氫青蒿素的合成一般是用硼氫化鈉(NaBH4)還原青蒿素.硼氫化物的合成方法有:
2LiH+B2H6=2LiBH4; 4NaH+BF3═NaBH4+3NaF
①寫出BH4﹣的等電子體_________(分子、離子各寫一種);
②B2H6分子結構如圖,2個B原子和一個H原子共用2個電子形成3中心二電子鍵,中間的2個氫原子被稱為“橋氫原子”,它們連接了2個B原子.則B2H6分子中有______種共價鍵,B原子的雜化方式為________ ;
③NaBH4的陰離子中一個B原子能形成4個共價鍵,而冰晶石(Na3AlF6)的陰離子中一個Al原子可以形成6個共價鍵,原因是______________;
④NaH的晶胞如圖,則NaH晶體中陽離子的配位數是_________;設晶胞中陰、陽離子為剛性球體且恰好相切,求陰、陽離子的半徑比![]() =__________。
=__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關物質的性質與用途具有對應關系的是
A. SO2具有氧化性,可用于漂泊紙漿
B. NH4HCO3 受熱易分解,可用作氮肥
C. 明礬溶于水產生的SO42- 有氧化性,可用于凈水
D. 常溫下鐵能被濃硝酸鈍化,可用鐵質容器貯運濃硝酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物的結構簡式如圖,下列該有機物的說法不正確的是( )

A. 該化合物分子式為 C12H14ON2
B. 1 mol 該物質可與 5 mol H2 加成
C. 能使酸性高錳酸鉀溶液和溴水褪色,且原理相同
D. 能在一定條件下發生加聚反應得到多種高聚物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關環境保護與綠色化學的敘述不正確的是( )
A.形成酸雨的主要物質是硫的氧化物和氮的氧化物
B.大氣污染物主要來自化石燃料燃燒和工業生產過程產生的廢氣
C.綠色化學的核心就是如何對被污染的環境進行無毒無害的治理
D.水華、赤潮等水體污染主要是由含氮、磷的生活污水任意排放造成的
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol,這個熱化學方程式表示
A. 2g碳燃燒生成一氧化碳時放出221.0kJ的熱量
B. 2mol碳燃燒生成一氧化碳時吸收221.0kJ的熱量
C. 2mol固體碳在氧氣中燃燒生成2mol一氧化碳氣體時放出221.0kJ的熱量
D. 12g碳和氧氣反應生成一氧化碳時放出221.0kJ的熱量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素 A、B、C、D、E、F 的原子序數依次增大,A 原子核外最外 層電子數是其電子層數的 2 倍,A、B 的核電荷數之比為 3:4。C 與 D 均為金屬元素,5.8 g D 的氫氧化物恰好能與 100 mL 2 mol·L-1 鹽酸完全反應,D 原子核中質子數和中子數相等。E 與F 相鄰,F-的最外層為 8 電子結構。根據上述條件,用化.學.用.語.回答:
(1)D 在周期表中的位置____;
(2)B、C 易形成淡黃色化合物,其電子式為____,該物質含有的化學鍵 類型為_____;
(3)用電子式表示 DF2 的形成過程____;
(4)元素 E、F 中非金屬性較強的是____,請用一個置換反應證明____(寫化學反應方程式);
(5)原子半徑:C____E;熔點:DB____CF(填“>”“<”或“=”);
(6)A、B、E 可形成一個三原子分子,且每個原子均達到 8 電子穩定結構,則該分子的 結構式為____;含 A元素的化合物在是自然界種類最多的原因是____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液中大量存在五種離子:NO3-、SO42-、 Fe3+、H+、X,其物質的量之比為:n(NO3-)︰n(SO42-)︰n(Fe3+)︰n(H+)︰n(X)=2︰3︰1︰3︰1,則X可能為
A. Fe2+ B. Mg2+ C. Cl- D. Ba2+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將等物質的量的X、Y氣體充入一個密閉容器中,在一定條件下發生如下反應并達到平衡:X(g)+Y(g)![]() 2Z(g) ΔH<0。當改變某個條件并達到新平衡后,下列敘述正確的是( )
2Z(g) ΔH<0。當改變某個條件并達到新平衡后,下列敘述正確的是( )
A. 升高溫度,X的體積分數減小
B. 增大壓強(縮小容器體積),Z的濃度不變
C. 保持容器體積不變,充入一定量的惰性氣體,Y的濃度不變
D. 保持容器體積不變,充入一定量的Z,X的體積分數增大
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com