
【題目】輝銅礦(主要成分是Cu2S)含銅量高,是最重要的煉銅礦石。請回答下列問題:
Ⅰ.已知:①2Cu2S(s)+3O2(g) ![]() 2Cu2O(s)+2SO2(g) ΔH=768.2kJ·mol1
2Cu2O(s)+2SO2(g) ΔH=768.2kJ·mol1
②Cu2S(s)+O2(g)![]() 2Cu(s)+SO2(g) ΔH=217.4 kJ·mol1
2Cu(s)+SO2(g) ΔH=217.4 kJ·mol1
(1)Cu2S與Cu2O反應生成Cu和SO2的熱化學方程式為____________,該反應中Cu2O作_________(填“氧化劑”或“還原劑”)。
Ⅱ.Cu2O可催化二甲醚合成乙醇。
反應①:CH3OCH3(g)+CO(g)![]() CH3COOCH3(g) ΔH1
CH3COOCH3(g) ΔH1
反應②:CH3COOCH3(g)+2H2(g)![]() CH3OH(g)+C2H5OH(g) ΔH2
CH3OH(g)+C2H5OH(g) ΔH2
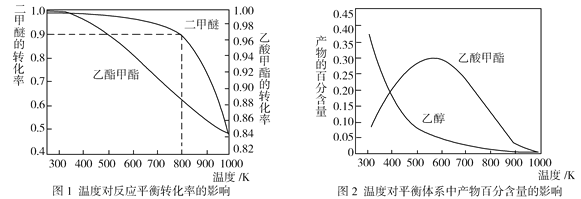
(2)壓強為p kPa時,同一體系中發生反應①和反應②,溫度對二甲醚(CH3OCH3)和乙酸甲酯(CH3COOCH3)平衡轉化率的影響如圖1所示,則ΔH1______0(填“>”或“<”,下同)、ΔH2______0。溫度對平衡體系中乙酸甲酯的百分含量和乙醇的百分含量的影響如圖2所示。在300~600 K范圍內,乙酸甲酯的百分含量逐漸增大,而乙醇的百分含量逐漸減小的原因是____________。
(3)若壓強為p kPa、溫度為800 K時,向2 L恒容密閉容器中充入1 mol CH3OCH3和1 mol CO發生反應①,2min時達到平衡,則前2min內CH3COOCH3的平均生成速率為_________,該條件下平衡常數K=_____________。
【答案】 2Cu2O(s)+Cu2S(s)![]() 6Cu(s)+SO2(g) ΔH=+116.0kJ/mol 氧化劑 < < 300~600 K范圍內,隨著溫度升高,反應①對應的平衡體系向逆反應方向移動的程度比反應②的小 0.225mol·Ll·min1 180
6Cu(s)+SO2(g) ΔH=+116.0kJ/mol 氧化劑 < < 300~600 K范圍內,隨著溫度升高,反應①對應的平衡體系向逆反應方向移動的程度比反應②的小 0.225mol·Ll·min1 180
【解析】(1)Cu2S與Cu2O反應生成Cu和SO2的化學方程式為Cu2S+2Cu2O![]() 6Cu+SO2↑,由②×3①,可得2Cu2O(s)+Cu2S(s)
6Cu+SO2↑,由②×3①,可得2Cu2O(s)+Cu2S(s) ![]() 6Cu(s)+SO2(g) ΔH=+116.0 kJ/mol。反應中Cu2S中Cu化合價降低,S元素化合價升高,既是氧化劑又是還原劑,Cu2O中Cu化合價降低,是氧化劑。
6Cu(s)+SO2(g) ΔH=+116.0 kJ/mol。反應中Cu2S中Cu化合價降低,S元素化合價升高,既是氧化劑又是還原劑,Cu2O中Cu化合價降低,是氧化劑。
(2)由圖1可知,壓強相同,溫度升高,二甲醚和乙酸甲酯的平衡轉化率均減小,則ΔH1和ΔH2都小于0,即ΔH1<0,ΔH2<0。溫度升高,反應①和反應②均逆向移動,但反應②受溫度影響更大,逆向移動程度更大,導致乙酸甲酯的百分含量增大,乙醇的百分含量逐漸減小。
(3)由圖1可知,壓強為p kPa、溫度為800 K時,CH3OCH3的平衡轉化率為0.9,根據已知條件,列出反應①的三段式: CH3OCH3(g)+CO(g)![]() CH3COOCH3(g)
CH3COOCH3(g)
起始濃度/mol·Ll 0.5 0.5 0
轉化濃度/mol·Ll 0.45 0.45 0.45
平衡濃度/mol·Ll 0.05 0.05 0.45
v(CH3COOCH3)=0.45 mol/L÷2 min=0.225mol·Ll·min1;
K=![]() =
=![]() =180。
=180。


科目:高中化學 來源: 題型:
【題目】現有部分短周期元素的性質或原子結構如表所示:
元素編號 | 元素性質或原子結構 |
T | M層上電子數是K層上電子數的3倍 |
X | 最外層電子數是次外電子數的2倍 |
Y | 常溫下單質為雙原子分子,其氫化物水溶液呈堿性 |
Z | 元素最高正價是+7價 |
(1)元素X位于元素周期表的第________周期______族;
(2)元素Y的原子結構示意圖為________。
(3)元素Z與元素T相比,非金屬性較強的是________(用元素符號表示),下列表述中能證明這一事實的是________(填序號)。
a.常溫下Z的單質和T的單質狀態不同
b.Z的氫化物比T的氫化物穩定
c.一定條件下Z和T的單質都能與氫氧化鈉溶液反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知![]() 與足量的10mol/L硫酸液混合微熱,產生下列現象:①有紅色金屬生成②產生刺激性氣味的氣體③溶液呈現藍色。據此判斷下列說法正確的是
與足量的10mol/L硫酸液混合微熱,產生下列現象:①有紅色金屬生成②產生刺激性氣味的氣體③溶液呈現藍色。據此判斷下列說法正確的是
A. 反應中硫酸作氧化劑
B. ![]() 中硫元素被氧化
中硫元素被氧化
C. 刺激性氣味的氣體是氨氣
D. 1mol![]() 完全反應轉移0.5mol電子
完全反應轉移0.5mol電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】最近科學家利用下列裝置圖成功地實現了CO2和H2O合成CH4。下列敘述錯誤的是

A. 電池工作時,實現了將太陽能轉化為電能
B. 銅電極為正極,電極反應式為CO2-8e-+8H+=CH4+2H2O
C. 電池內 H+ 透過質子交換膜從左向右移動
D. 為提高該人工光合系統的工作效率,可向裝置中加入少量稀硫酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組離子,能大量共存的是
A.Fe3+、Na+、OH-、Cl-B.Ag+、K+、Cl-、NO3-
C.CO32-、H+、Ca2+、Cl-D.Na+、Cl-、OH-、K+
查看答案和解析>>
科目:高中化學 來源: 題型:
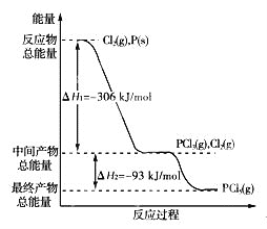
【題目】紅磷P(s)和Cl2(g)發生反應生成PCl3(g)和PCl5(g)。反應過程和能量關系如圖所示(圖中的ΔH表示生成1 mol產物的數據)。
根據上圖回答下列問題:
(1)P和Cl2反應生成PCl3的熱化學方程式是________________________________________;
(2)PCl5分解成PCl3和Cl2的熱化學方程式是_________________________。
(3)P和Cl2分兩步反應生成1 mol PCl5的反應熱ΔH3= ___________,P和Cl2一步反應生成1 mol PCl5的ΔH4 ____________ΔH3(填“大于”、“小于”或“等于”);
(4)PCl5與足量水充分反應,最終生成兩種酸,其化學方程式是____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】漢黃芩素是傳統中草藥黃芩的有效成分之一,對腫瘤細胞的殺傷有獨特作用。下列有關漢黃芩素的敘述正確的是
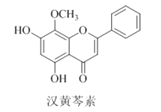
A. 漢黃芩素的分子式為C16H13O5
B. 該物質屬于芳香烴
C. 1 mol該物質與溴水反應,最多消耗2 mol Br2
D. 與足量H2發生加成反應后,該分子中官能團的種類減少1種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某KCl樣品中含有少量K2CO3、K2SO4和不溶于水的雜質,為了提純KCl,先將樣品溶于適量水中,攪拌、過濾,再將濾液按下圖所示步驟進行提純(過濾操作已略去)。下列說法不正確的是

A. 起始濾液常溫下pH﹥7 B. 試劑Ⅰ為BaCl2溶液
C. 上圖過程必須經2次過濾 D. 步驟③目的是除去CO32-
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com