
(12分)氧化還原反應在生產、生活中具有廣泛的用途,貫穿古今。
(1)下列生產、生活中的事例中發生了氧化還原反應的是
(2)水是人體的重要組成部分,是人體中含量最多的一種物質。而“四種基本反應類型與氧化還原反應的關系”也可用如圖表達。
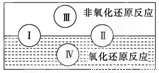
試寫出有水參加的符合反應類型Ⅳ的一個化學方程式:
其中水為________劑。
(3)“細菌冶金”是利用某些細菌的特殊代謝功能開采金屬礦石,例如溶液中氧化亞鐵硫桿菌能利用空氣中的氧氣將黃鐵礦(主要成分FeS2)氧化為Fe2(SO4)3,并使溶液酸性增強。
①該過程反應的化學方程式為__________________________。
②人們可利用Fe2(SO4)3作強氧化劑溶解銅礦石(Cu2S),然后加入鐵屑進一步得到銅,該過程中發生的離子反應方程式如下,請補充完整并配平:
________Cu2S+________Fe3++______H2O________Cu2++________Fe2++________( )+________SO42-。
(4)羥胺(NH2OH)是一種還原劑,用25.00 mL 0.049 mol/L羥胺的酸性溶液跟足量的硫酸鐵溶液在煮沸條件下反應,生成的Fe2+離子恰好與24.5 mL 0.020 mol/L的KMnO4酸性溶液反應。則在上述反應中,羥胺的氧化產物是 。
(1)D (2)C+H2O(g) CO+H2(2分)
氧化(合理即可)
CO+H2(2分)
氧化(合理即可)
(3)①4FeS2+15O2+2H2O 2Fe2(SO4)3+2H2SO4(2分)
2Fe2(SO4)3+2H2SO4(2分)
②1 10 4 2 10 8 H+(2分)
(4)N2O(2分)
【解析】(1)ABC都是物理變化,燃燒是氧化還原反應,答案選D。
(2)Ⅳ是置換反應,所以方程式可以是C+H2O(g) CO+H2,在該反應中水是氧化劑。
CO+H2,在該反應中水是氧化劑。
(3)①溶液酸性增強,說明反應中還生成硫酸,所以方程式為4FeS2+15O2+2H2O 2Fe2(SO4)3+2H2SO4。
2Fe2(SO4)3+2H2SO4。
②根據原子守恒可知,另一種生成物是氫離子。1molCu2S失去10mol電子,所以需要氧化劑Fe3+是10mol,然后觀察法配體其它的。
(4)設羥胺的氧化產物中氮元素的化合價是n,則根據電子的得失守恒可知,25×0.049×(n+1)=24.5×0.020×(7-2),解得n=1,所以氧化產物是N2O。


 優翼小幫手同步口算系列答案
優翼小幫手同步口算系列答案科目:高中化學 來源: 題型:

| ||
| ||
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com