
在溫度為298K時,將0.10 mol無色的N2O4氣體放入1L抽空的密閉容器中,出現紅棕色,直至建立N2O4(g) 2NO2(g)的平衡。下圖表示測定N2O4的濃度與時間關系的曲線(縱坐標為N2O4的濃度,橫坐標為時間)。
2NO2(g)的平衡。下圖表示測定N2O4的濃度與時間關系的曲線(縱坐標為N2O4的濃度,橫坐標為時間)。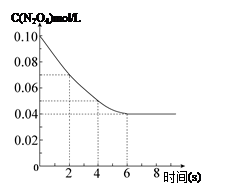
|
| T/K | 310 | 320 |
| K值 | 0.38 | 0.42 |

解析試題分析:(1)由圖像可知2s至4s時間內N2O4的濃度變化為0.02 mol/L,根據v=△c/△t結合反應速率之比等于化學計量數之比計算可得,注意寫清單位;
(2)對于一定條件下的可逆反應,無論反應從正向開始還是從逆向開始,只要最初加入的物質的量相當,就會達到同一平衡狀態。由圖像可知c(N2O4)的初始濃度為0.10mol/L,要達到同樣的平衡狀態,二氧化氮的起始濃度是0.20mol·L-1
(3)根據N2O4的起始濃度和轉化濃度求出轉化率;根據N2O4和NO2的平衡濃度和平衡常數表達式求平衡常數;
(4)對于一定條件下的可逆反應N2O4(g) 2NO2(g)達平衡后再充入0.10 mol N2O4氣體,增大了反應物濃度平衡向正向移動;再加入N2O4后,平衡狀態相當于增大壓強,平衡左移,N2O4的轉化率減小;
2NO2(g)達平衡后再充入0.10 mol N2O4氣體,增大了反應物濃度平衡向正向移動;再加入N2O4后,平衡狀態相當于增大壓強,平衡左移,N2O4的轉化率減小;
(5)由表中數據可知,溫度升高,平衡常數增大,則說明升高溫度,平衡向正反應方向移動,則正反應為吸熱反應;
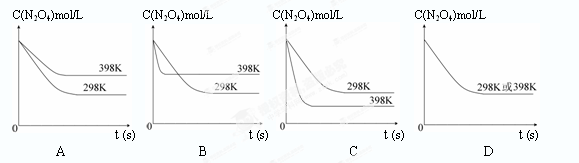
(6)可逆反應N2O4(g) 2NO2(g) 正反應為吸熱反應,升溫平衡向正向移動,N2O4的平衡濃度減小,升溫反應速率加快,可縮短達平衡的時間,結合圖像選C。
2NO2(g) 正反應為吸熱反應,升溫平衡向正向移動,N2O4的平衡濃度減小,升溫反應速率加快,可縮短達平衡的時間,結合圖像選C。
考點:考查了化學反應速率的計算、化學平衡的三段式計算應用、影響因素的分析判斷方法、,平衡常數的計算應用及相關圖像。


科目:高中化學 來源: 題型:填空題
活性炭可處理大氣污染物NO。T℃時,在1L密閉容器中加入NO氣體和炭粉,發生反應生成兩種氣體A和B,測得各物質的物質的量如下:
| | 活性炭/mol | NO/mol | A/mol | B/mol |
| 起始狀態 | 2.030 | 0.100 | 0 | 0 |
| 2 min時 | 2.000 | 0.040 | 0.030 | 0.030 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
在一定體積的密閉容器中,進行如下化學反應:
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g),其化學平衡常數K和溫度t的關系如下表:
2Fe(s)+3CO2(g),其化學平衡常數K和溫度t的關系如下表:
| t℃ | 1000 | 1150 | 1300 |
| K | 64.0 | 50.7 | 42.9 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
工業上一般以CO和H2為原料合成甲醇,該反應的熱化學方程式為:
CO ( g ) + 2H2 ( g )  CH3OH ( g ) △H=-116kJ/mol
CH3OH ( g ) △H=-116kJ/mol
(1)該反應的化學平衡常數表達式為 ;
(2)下列措施中有利于增大該反應的反應速率且提高轉化率的是 (填字母序號) 。
a.隨時將CH3OH與反應混合物分離 b.降低反應溫度
c.使用高效催化劑 d.增大體系壓強
(3)一定條件下,將1 mol CO與3 mol H2的混合氣體在催化劑作用下發生反應生成甲醇,平衡后將容器的容積壓縮到原來的l/2,其他條件不變,對平衡體系產生的影響是 (填字母序號).
a.c ( H2 )減少 b.正反應速率加快,逆反應速率減慢
c.CH3OH 的物質的量增加 d.重新平衡c ( H2 )/ c (CH3OH )減小
(4) 在密閉容器中充有1mol CO與2 mol H2,在催化劑作用下反應生成甲醇,CO的轉化率(α)與溫度(T)、壓強(P)的關系如圖所示。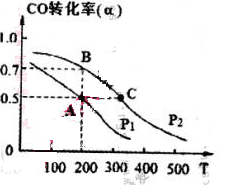
①A、C兩點都表示達到的平衡狀態,則自反應開始到達平衡狀態所需的時間,tA tC(填“大于”、“小于’’或“等于")。
②若A點時容器的體積為1 L,該溫度下B點的平衡常數 K= 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
一定條件下,反應室(容積恒定為2L)中有反應:A(g) +2B(g) C(g)
C(g)
(1)能說明上述反應達到平衡狀態的是 (選填字母)。
A.反應中A與B的物質的量濃度之比為1︰2
B.混合氣體總物質的量不再變化
C.混合氣體的密度不隨時間的變化而變化
D.2υ正(A)= υ逆(B)
(2)該反應平衡常數K的表達式:K= 。
(3)1molA(g)與2molB(g)在催化劑作用下在反應室反應生成C(g),A的平衡轉化率與溫度、壓強的關系如下圖所示,則:
①P1 P2 , 正反應的△H 0(填“<”、“>”或“=”)。
②下列措施中一定能使c(C)/c(A)增大的是 (選填編號)。
A.升高溫度 B.恒溫恒容再充入A
C.恒溫恒容再充入B D.恒溫恒容再充入1 mol C
(4)100℃時將1mol A和2molB通入反應室,保持溫度不變,10min末C(g) 的濃度為0.05mol/L ,則10min末B轉化率= ,此時υ正 υ逆
(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
工業上利用CO和水蒸氣在一定條件下發生反應制取氫氣:CO(g)+H2O(g) CO2(g)+H2(g)某研究小組分別在體積均為2L的恒容密閉容器中加入一定量的反應物,使其發生反應,相關數據如下:
CO2(g)+H2(g)某研究小組分別在體積均為2L的恒容密閉容器中加入一定量的反應物,使其發生反應,相關數據如下:
| 容器編號 | 溫度℃ | 起始量/mol | 平衡量/mol | 達到平衡的時間/min | 達到平衡時體系能量的變化/kJ | ||
| CO | H2O | CO2 | H2 | ||||
| ① | 650 | 1 | 2 | 0.4 | 0.4 | 5 | 16.4 |
| ② | 650 | 2 | 4 | | | t1 | Q1 |
| ③ | 900 | 2 | 4 | 1.6 | 1.6 | t2 | Q2 |
 =__________。
=__________。 CO2(g)+H2(g) △H= -41kJ/mol
CO2(g)+H2(g) △H= -41kJ/mol查看答案和解析>>
科目:高中化學 來源: 題型:填空題
對于A(g)+B(g)  xC(g) ΔH 有:
xC(g) ΔH 有: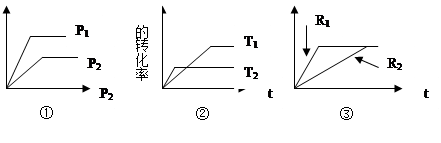
(1)①圖表明P1 P2 ,且x的值為 ;
(2)②圖表明T1 T2 ,且ΔH 0;
(3)如果③圖R1,R2分別表示改變壓強,則R1 R2 ,x的值為 ;
(4)如果③圖分別表示有無催化劑,則R1表示 催化劑。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(6分)已知:T℃、P kpa時,容積為V 的密閉容器中充有1molA和2molB,保持恒溫恒壓使反應達平衡:A(g)+B(g) C(g),平衡時C 的體積分數為40℅。
C(g),平衡時C 的體積分數為40℅。
(1)欲保持溫度、壓強在上述條件下不變,在密閉容器中充入2molA和4molB,則平衡時體系容積為 ,C的體積分數為 。
(2)另取一個容積固定不變的密閉容器,仍控制溫度為T℃,加入1molB和1molC,要使平衡時C 的體積分數仍為40℅,則該密閉容器體積為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
如圖是煤化工產業鏈的一部分,試運用所學知識,解決下列問題:
(1)已知該產業鏈中某反應的平衡常數表達式為: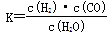 ,它所對應反應的化學方程式是
,它所對應反應的化學方程式是
_________________________________。
(2)合成甲醇的主要反應是:2H2(g)+CO(g) CH3OH(g)+90.8kJ,t℃下此反應的平衡常數為160。此溫度下,在密閉容器中開始只加入CO、H2,反應l0min后測得各組分的濃度如下:
CH3OH(g)+90.8kJ,t℃下此反應的平衡常數為160。此溫度下,在密閉容器中開始只加入CO、H2,反應l0min后測得各組分的濃度如下:
| 物質 | H2 | CO | CH3OH |
| 濃度(mol/L) | 0.2 | 0.1 | 0.4 |
| 反應 | 大氣固氮 | 工業固氮 | ||||
| 溫度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com