
在一定體積的密閉容器中,進(jìn)行如下化學(xué)反應(yīng):
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g),其化學(xué)平衡常數(shù)K和溫度t的關(guān)系如下表:
2Fe(s)+3CO2(g),其化學(xué)平衡常數(shù)K和溫度t的關(guān)系如下表:
| t℃ | 1000 | 1150 | 1300 |
| K | 64.0 | 50.7 | 42.9 |
(1)k=c(CO2)3/c(CO)3;(2)放熱反應(yīng) (3)b、c (4)0.006 mol?L-1?min-1 60%
解析試題分析:(1)可逆反應(yīng)Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g)的化學(xué)平衡常數(shù)表達(dá)式k=c(CO2)3/c(CO)3;(2)由表中數(shù)據(jù)可知,溫度越高化學(xué)平衡常數(shù)越小,升高溫度平衡向逆反應(yīng)移動(dòng),正反應(yīng)是放熱反應(yīng);(3)a.無論反應(yīng)是否達(dá)到平衡,該反應(yīng)的壓強(qiáng)均不變 ,故不能說明到達(dá)平衡狀態(tài),故a錯(cuò)誤;
2Fe(s)+3CO2(g)的化學(xué)平衡常數(shù)表達(dá)式k=c(CO2)3/c(CO)3;(2)由表中數(shù)據(jù)可知,溫度越高化學(xué)平衡常數(shù)越小,升高溫度平衡向逆反應(yīng)移動(dòng),正反應(yīng)是放熱反應(yīng);(3)a.無論反應(yīng)是否達(dá)到平衡,該反應(yīng)的壓強(qiáng)均不變 ,故不能說明到達(dá)平衡狀態(tài),故a錯(cuò)誤;
b.反應(yīng)達(dá)到平衡狀態(tài)時(shí),各物質(zhì)的濃度不變,混合氣體中c(CO)不變說明到達(dá)平衡狀態(tài),故b正確;
c.v (H2)正="v" (H2O)逆不同物質(zhì)表示的速率之比等于化學(xué)計(jì)量數(shù)之比,說明到達(dá)平衡狀態(tài),故c正確;d.反應(yīng)始終按CO與CO2物質(zhì)的量之比為1:1進(jìn)行,c(H2)=c(CO)不能說明到達(dá)平衡,故d錯(cuò)誤;令平衡時(shí)CO的物質(zhì)的量變化為nmol,則:
Fe2O3(s)+3CO(g)?2 Fe(s)+3CO2(g)
開始(mol):1 1
變化(mol):n 1+n
平衡(mol):1-n 1+n
所以[(1+n)/V]/[(1?n )V]=4,解得n=0.6,所以n(CO2)="0.6mol/10L/10min=0.006" mol?L-1?min-1,CO的平衡轉(zhuǎn)化率為0.6mol 1mol×100%=60%。
考點(diǎn):化學(xué)平衡常數(shù)及其計(jì)算,反應(yīng)熱,化學(xué)平衡移動(dòng)判斷,轉(zhuǎn)化率計(jì)算。


 桃李文化快樂暑假武漢出版社系列答案
桃李文化快樂暑假武漢出版社系列答案 優(yōu)秀生快樂假期每一天全新寒假作業(yè)本系列答案
優(yōu)秀生快樂假期每一天全新寒假作業(yè)本系列答案 暑假接力賽新疆青少年出版社系列答案
暑假接力賽新疆青少年出版社系列答案
| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來源: 題型:填空題
工業(yè)制硫酸的過程中利用反應(yīng)2SO2(g)+O2(g) 2SO3(g);△H<0,將SO2轉(zhuǎn)化為SO3,尾氣SO2可用NaOH溶液進(jìn)行吸收。請回答下列問題:
2SO3(g);△H<0,將SO2轉(zhuǎn)化為SO3,尾氣SO2可用NaOH溶液進(jìn)行吸收。請回答下列問題:
(1)一定條件下,向一帶活塞的密閉容器中充入2molSO2和1molO2發(fā)生反應(yīng),則下列說法正確的是 。
A.若反應(yīng)速率v(SO2)=v(SO3),則可以說明該可逆反應(yīng)已達(dá)到平衡狀態(tài)
B.保持溫度和容器體積不變,充入2 mol N2,化學(xué)反應(yīng)速率加快
C.平衡后僅增大反應(yīng)物濃度,則平衡一定右移,各反應(yīng)物的轉(zhuǎn)化率一定都增大
D.平衡后移動(dòng)活塞壓縮氣體,平衡時(shí)SO2、O2的百分含量減小,SO3的百分含量增大
E.保持溫度和容器體積不變,平衡后再充入2molSO3,再次平衡時(shí)各組分濃度均比原平衡時(shí)的濃度大
F.平衡后升高溫度,平衡常數(shù)K增大
(2)將一定量的SO2(g)和O2(g)分別通入到體積為2L的恒容密閉容器中,在不同溫度下進(jìn)行反應(yīng)得到如下表中的兩組數(shù)據(jù):
| 實(shí)驗(yàn)編號(hào) | 溫度/℃ | 起始量/mol | 平衡量/mol | 達(dá)到平衡所需時(shí)間/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
工業(yè)上制取三氧化硫反應(yīng)的熱化學(xué)方程式為:
2SO2(g)十O2(g)  2SO3(g) △H=-198kJ·mol-1
2SO3(g) △H=-198kJ·mol-1
(1)能夠說明在恒溫恒容條件下,上述反應(yīng)已經(jīng)達(dá)到化學(xué)平衡狀態(tài)的是 (填序號(hào))。
A.每生成1mol SO3的同時(shí)生成0.5mol O2
B.容器中混合氣體的密度不變
C.SO2、O2、SO3的物質(zhì)的量之比為2:1:2
D.容器中氣體總壓強(qiáng)不變
(2)400℃,1.01×105Pa下,上述反應(yīng)中n(SO3)和n(O2)隨時(shí)間變化的關(guān)系如圖所示。下列敘述正確的是 (填序號(hào))。
A.點(diǎn)a的正反應(yīng)速率比點(diǎn)b的大
B.點(diǎn)c處反應(yīng)達(dá)到平衡狀態(tài)
C.點(diǎn)d和點(diǎn)e處的n(O2)相同
D.500℃,1.01×105Pa下,反應(yīng)達(dá)到平衡時(shí),n(SO3)比圖中e點(diǎn)的值大
(3)已知該反應(yīng)的K(400℃)=7200mol-1·L。在400℃時(shí),容積為1.0L的密閉容器中充入0.05mol SO2(g)和0.03mol O2(g),反應(yīng)一段時(shí)間后,有0.04mol SO3生成。此時(shí),該反應(yīng) (填“是”、“否”或“無法判斷”)達(dá)到化學(xué)平衡狀態(tài),理由是 。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
(1)二氧化硫的催化氧化的過程如圖所示,其中a、c二步的化學(xué)方程式可表示為: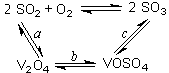
SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
該反應(yīng)的催化劑是 (寫化學(xué)式)
(2) 550 ℃時(shí),SO2轉(zhuǎn)化為SO3的平衡轉(zhuǎn)化率(α)與體系總壓強(qiáng)(p)的關(guān)系如圖所示。將2.0 mol SO2和1.0 mol O2置于5 L密閉容器中,反應(yīng)達(dá)平衡后,體系總壓強(qiáng)為0.10 M Pa。試計(jì)算反應(yīng)2SO3 2SO2+O2在550 ℃時(shí)的平衡常數(shù)K= 。
2SO2+O2在550 ℃時(shí)的平衡常數(shù)K= 。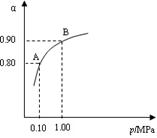
(3)550 ℃時(shí),將2.0 mol SO2和1.0 mol O2置于5 L密閉容器中,反應(yīng) 達(dá)平衡后,下列措施中能使n(SO3)/n(SO2)增大的是
A.升高溫度
B.充入He(g),使體系總壓強(qiáng)增大
C.再充入2 mol SO2和1 mol O2
D.再充入1 mol SO2和1 mol O2
(4)維持溫度不變條件下使之發(fā)生如下反應(yīng):2SO2+O2 2SO3,有兩只密閉容器A和B。A容器有一個(gè)可以移動(dòng)的活塞能使容器內(nèi)保持恒壓,B容器能保持恒容。起始時(shí)向這兩個(gè)容器中分別充入等物質(zhì)的量的體積比為2∶1的SO2和O2的混合氣體,并使A和B容積相等(如下圖所示)。
2SO3,有兩只密閉容器A和B。A容器有一個(gè)可以移動(dòng)的活塞能使容器內(nèi)保持恒壓,B容器能保持恒容。起始時(shí)向這兩個(gè)容器中分別充入等物質(zhì)的量的體積比為2∶1的SO2和O2的混合氣體,并使A和B容積相等(如下圖所示)。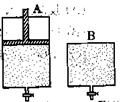
試填寫下列空格:
A容器達(dá)到平衡時(shí)所需的時(shí)間比B容器__________(填:“短或長”);平衡時(shí)A容器中SO2的轉(zhuǎn)化率比B容器_______(填:“大或小”);達(dá)到所述平衡后,若向兩容器中通入等物質(zhì)的量的原反應(yīng)氣體,達(dá)到平衡時(shí),A容器的混合氣體中SO3的體積分?jǐn)?shù)_________(填“增大”、“減小”或“不變”,下同);B容器的混合氣體中SO3的體積分?jǐn)?shù)_________。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
反應(yīng)aA+bB  cC在體積為2L的容器中進(jìn)行反應(yīng)。在Ⅰ、Ⅱ、Ⅲ階段體系中各物質(zhì)的量隨時(shí)間變化的曲線如下圖所示:
cC在體積為2L的容器中進(jìn)行反應(yīng)。在Ⅰ、Ⅱ、Ⅲ階段體系中各物質(zhì)的量隨時(shí)間變化的曲線如下圖所示:
請回答下列各題:
(1)反應(yīng)的化學(xué)方程式為_____________________________
(2)A的平均反應(yīng)速率vI(A)、vⅡ(A)、vⅢ(A)從大到小排列次序?yàn)開_______________
(3)由計(jì)算可知,第Ⅰ段20分鐘時(shí),C的平均速率vI(C)=____________________
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
如圖所示,B中活塞可以自由滑動(dòng)。A、B中均有1mol X、1mol Y,起始時(shí),V(A)=V(B)=a L。關(guān)閉K,相同溫度下,兩容器中同時(shí)發(fā)生反應(yīng):2X(g)+2Y(g) Z(g)+2W(g) ΔH<0,達(dá)到平衡(Ⅰ)時(shí),V(B)=0.8a L。
Z(g)+2W(g) ΔH<0,達(dá)到平衡(Ⅰ)時(shí),V(B)=0.8a L。
(1)達(dá)到平衡所需的時(shí)間:A B。(填“>”、“<”、或“=”,下同)
(2)W的百分含量:A B。
(3)B中X的轉(zhuǎn)化率為 。
(4)打開K,重新達(dá)平衡(Ⅱ)時(shí),B的體積為 L(用含a的式子表示,連通管體積忽略不計(jì))。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
請運(yùn)用化學(xué)反應(yīng)原理的相關(guān)知識(shí)研究碳及其化合物的性質(zhì)。
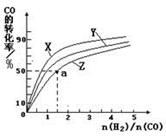
(1)工業(yè)上一般以CO和H2為原料合成甲醇,在恒容容器中,該反應(yīng)的熱化學(xué)方程式為:
CO(g)+2H2(g)  CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①下列措施中能說明反應(yīng)達(dá)到平衡狀態(tài)的是___________
| A.體系壓強(qiáng)保持不變 |
| B.混合氣體的密度保持不變 |
| C.CO與H2的濃度之比為1∶2 |
| D.單位時(shí)間內(nèi),消耗2molH2的同時(shí)消耗1mol CH3OH |
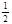 O2(g)=CO2(g) △H2=-283 kJ·mol-1 H2(g)+
O2(g)=CO2(g) △H2=-283 kJ·mol-1 H2(g)+ 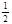 O2(g)=H2O(g) △H3=-242 kJ·mol-1
O2(g)=H2O(g) △H3=-242 kJ·mol-1查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
在溫度為298K時(shí),將0.10 mol無色的N2O4氣體放入1L抽空的密閉容器中,出現(xiàn)紅棕色,直至建立N2O4(g) 2NO2(g)的平衡。下圖表示測定N2O4的濃度與時(shí)間關(guān)系的曲線(縱坐標(biāo)為N2O4的濃度,橫坐標(biāo)為時(shí)間)。
2NO2(g)的平衡。下圖表示測定N2O4的濃度與時(shí)間關(guān)系的曲線(縱坐標(biāo)為N2O4的濃度,橫坐標(biāo)為時(shí)間)。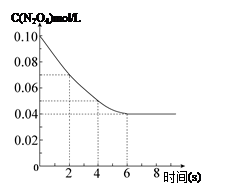
|
| T/K | 310 | 320 |
| K值 | 0.38 | 0.42 |
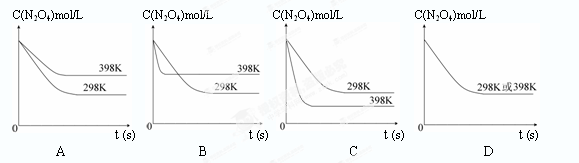
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
合成氨技術(shù)的創(chuàng)立開辟了人工固氮的重要途徑,其研究來自正確的理論指導(dǎo),合成氨反應(yīng)的平衡常數(shù)K值和溫度的關(guān)系如下:
| 溫 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
 CO(g)+3H2(g) 獲取,已知該反應(yīng)中,當(dāng)初始混合氣
CO(g)+3H2(g) 獲取,已知該反應(yīng)中,當(dāng)初始混合氣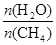 恒定時(shí),溫度、壓強(qiáng)對(duì)平衡混合氣CH4含量的影響如下圖所示:
恒定時(shí),溫度、壓強(qiáng)對(duì)平衡混合氣CH4含量的影響如下圖所示: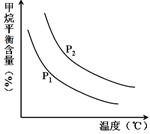
 CO2 (g)+H2(g) 獲取。
CO2 (g)+H2(g) 獲取。查看答案和解析>>
國際學(xué)校優(yōu)選 - 練習(xí)冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com