
【題目】請按要求回答下列問題:
(1)1-丁烯與溴水的反應 。
(2)相對分子質量為72的某烴,其一氯代物只有一種,則該烴的一氯代物的結構簡式為_________。
(3)用系統命名方法命名下列有機化合物
(CH3)2CHCH(CH3)2_____________________________;
 ______________________________;
______________________________;
(4)已知結構式為 的物質互為同分異構體,我們稱之為順反異構。則分子式為C5H10的有機物,屬于烯烴的同分異構體的數目為_________種(考慮順反異構)。
的物質互為同分異構體,我們稱之為順反異構。則分子式為C5H10的有機物,屬于烯烴的同分異構體的數目為_________種(考慮順反異構)。
【答案】(1) CH2=CH—CH2—CH3+Br2→BrCH2CHBrCH2CH3
(2)CH3C(CH3)2CH2Cl
(3)2,3﹣二甲基丁烷;2,4﹣二甲基﹣3﹣乙基己烷;
(4)6種
【解析】
試題分析:(1)1-丁烯含有碳碳雙鍵,與溴水發生加成反應的方程式為CH2=CH—CH2—CH3+Br2→BrCH2CHBrCH2CH3;
(2)有機物的相對分子質量為72,且僅含有碳和氫兩種元素,根據商余法72÷14=5…2,所以分子為C5H12;戊烷的同分異構體為正戊烷、異戊烷和新戊烷,其中一氯代物只有一種,說明結構簡式中所有H一種位置相同,滿足該條件的戊烷為新戊烷:C(CH3)4,該一氯代物的結構簡式為CH3C(CH3)2CH2Cl。
(3)(CH3)2CHCH(CH3)2中的主鏈上有4個碳,從離甲基的最近的一端編號,所以(CH3)2CHCH(CH3)2的名稱為2,3﹣二甲基丁烷;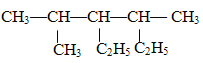 中的主鏈上有6個碳,為己烷,從離甲基最近的一端編號,所以名稱為2,4﹣二甲基﹣3﹣乙基己烷。
中的主鏈上有6個碳,為己烷,從離甲基最近的一端編號,所以名稱為2,4﹣二甲基﹣3﹣乙基己烷。
(4)分子式為C5H10的有機物,屬于烯烴的同分異構體有CH2=CHCH2CH2CH3、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,共計是6種。
,共計是6種。


科目:高中化學 來源: 題型:
【題目】【加試題】乙酰苯胺具有解熱鎮痛作用,是較早使用的解熱鎮痛藥,有“退熱冰”之稱,其制備原理如下:
已知:![]()
①苯胺易被氧化。
②乙酰苯胺、苯胺和醋酸的部分物理性質如下表:
物質 | 熔點/℃ | 沸點/℃ | 溶解性 |
乙酰苯胺 | 114.3 | 305 | 微溶于冷水,易溶于熱水 |
苯胺 | -6 | 184.4 | 微溶于水 |
醋酸 | 16.6 | 118 | 易溶于水 |
實驗步驟如下:
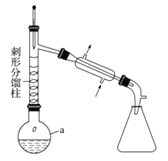
步驟1:在a中,加入9mL (0.10 mol)苯胺、15 mL(0.27 mol)冰醋酸及少許鋅粉,依照上圖裝置組裝儀器。
步驟2:控制溫度計讀數在105℃左右,小火加熱回流至反應完全。
步驟3:趁熱將反應混合物倒入盛有100 mL 冷水的燒杯中,冷卻后抽濾、洗滌,得到粗產品。
步驟4:將步驟3所得粗產品進一步提純后,稱得產品質量為10.8g。
請回答下列問題:
(1)儀器a的名稱為 ,所選儀器a的最佳規格是 (填序號)。
A. 25 mL B.50 mL C.100 mL D.250 mL
(2)實驗中加入少許鋅粉的目的是 。
(3)步驟2中,控制溫度計讀數在105℃左右的原因是 。
(4)判斷反應已基本完全的方法為 。
(5)步驟3中趁熱將混合物倒入盛有冷水的燒杯中,“趁熱”的原因是 。
(6)步驟4中粗產品進一步提純,該提純方法是 。
(7)本次實驗的產率為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有五種元素,其中A、B、C、D、E為原子序數依次增大,且原子序數都不超過36.請根據下列相關信息,回答問題.
A | 基態原子最外層電子數是次外層的三倍 |
B | 基態原子核外有13種不同運動狀態的電子 |
C | 與B同一周期,原子中未成對電子數是同周期中最多 |
D | D2-的核外電子排布與氬原子相同 |
E | 是ds區原子序數最小的元素 |
(1)請把B以及B同周期且原子序數比B小的原子按第一電離能從大到小的順序排列:____________(用相應的元素符號表示).A、D兩種元素中,電負性A____________D (填“>”或“<”)
(2)A3分子的空間構型為____________,與其互為等電子體的分子為____________;
(3)解釋在水中的溶解度C7H15OH比乙醇低的原因是:____________,C7H15OH 中采用sp3雜化的原子共有____________個;
(4)E(NH3)42+配離子中存在的化學鍵類型有____________(填序號):
①配位鍵 ②金屬鍵 ③極性共價鍵 ④非極性共價鍵 ⑤離子鍵 ⑥氫鍵
若 E(NH3)42+具有對稱的空間構型.且當 E(NH3)42+中的兩個NH3分子被兩個Cl一取代時。能得到兩種不同結構的產物,則 E(NH3)42+的空間構型為____________(填序號)。
a.平面正方形b.正四面體 c.三角錐形 d.V形
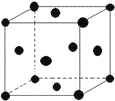
(5)單質E晶胞如圖所示,已知E元素相對原子質量為M,原子半徑為r pm,密度為ρg/cm3(1pm=10-10cm)那么寫出阿伏伽德羅常數NA的表達式____________(用M、r、ρ表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
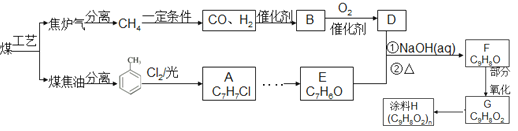
【題目】以煤為原料可合成涂料H(如下圖)。B分子式為C2H6O,能與鈉反應放出氫氣。(注:流程中某些反應條件沒有給出)。
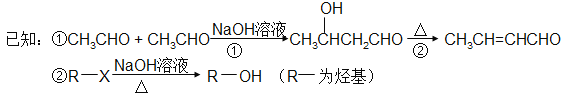
請回答:
(1)流程中煤的綜合利用的工藝名稱為 。
(2)B的結構簡式是 ,E中含氧官能團的名稱是 。
(3)G→H反應的化學方程式 。
(4)對于化合物F,下列說法正確的是 。
A、能發生銀鏡反應 B、能使Br2的CCl4溶液褪色
C、能發生水解反應 D、能與金屬鈉反應
(5)下列有機物與G不是互為同分異構體的是 。
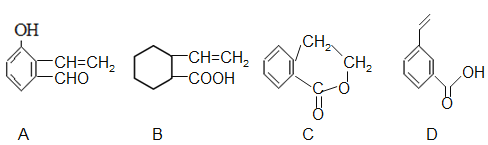
(6)從 →E 的合成路線(試劑及溶劑任選:合成路線參照“已知①”中書寫形式) 。
→E 的合成路線(試劑及溶劑任選:合成路線參照“已知①”中書寫形式) 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙炔是一種重要的有機化工原料,以乙炔為原料在不同的反應條件下可以轉化成以下化合物。
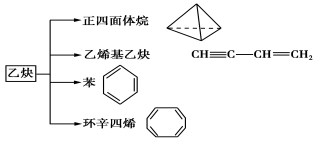
請回答下列問題:
(1)正四面體烷的分子式為________,其二氯取代產物有________種。
(2)下列關于乙烯基乙炔分子的說法錯誤的是________(填序號)。
a.能使酸性KMnO4溶液褪色
b.1 mol乙烯基乙炔能與3 mol Br2發生加成反應
c.乙烯基乙炔分子中含有兩種官能團
d.等質量的乙炔與乙烯基乙炔完全燃燒時的耗氧量不相同
(3)寫出與環辛四烯互為同分異構體且屬于芳香烴的有機物的結構簡式:________。
(4)寫出與苯互為同系物且一氯代物只有兩種的有機物的結構簡式(任舉一例即可):
_____ _____ ___。
(5)乙炔與氯化氫可以合成聚氯乙烯塑料,試寫出該過程的化學方程式。
① 。
② 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】阿魏酸在食品、醫藥等方面有著廣泛用途。一種合成阿魏酸的反應可表示為

下列說法正確的是
A. 可用酸性KMnO4溶液檢測上述反應是否有阿魏酸生成
B. 香蘭素、阿魏酸均可與Na2CO3、NaOH溶液反應
C. 通常條件下,香蘭素、阿魏酸都能發生取代、加成、消去反應
D. 與香蘭素互為同分異構體,分子中有4種不同化學環境的氫,且能發生銀鏡反應的酚類化合物共有2種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】堿性硼化釩(VB2)—空氣電池工作時反應為:4VB2 + 11O2 = 4B2O3 + 2V2O5。用該電池為電源,選用惰性電極電解硫酸銅溶液,實驗裝置如圖所示。當外電路中通過0.04mol電子時,B裝置內共收集到0.448L氣體(標準狀況),則下列說法正確的是
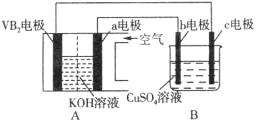
A.VB2電極發生的電極反應為:2VB2 + 11H2O - 22e- = V2O5 + 2B2O3 + 22H+
B.外電路中電子由c電極流向VB2電極
C.電解過程中,c電極表面先有紅色物質析出,后有氣泡產生
D.若B裝置內的液體體積為100 mL,則CuSO4溶液的物質的量濃度為0.05 mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,水的離子常數KW=10—13,將此溫度下pH=11的Ba(OH)2溶液aL與pH=1的H2SO4溶液bL混合,設混合溶液體積為兩者之和,所得固體體積忽略不計。
(1)若所得混合溶液為中性,則a:b=________,生成沉淀物質的量為______mol(用含b表達式來表示)。
(2)若a:b=9:2,則所得溶液pH=_____。該混合溶液最多能溶解鐵粉_______g(用含a、b表達式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(化學與技術)聚合氯化鋁晶體的化學式為[Al2(OH)nCl6-n·xH2O]m,它是一種高效無機水處理劑,它的制備原理是調節增大AlCl3溶液的pH,通過促進其水解而結晶析出。其制備原料主要是鋁加工行業的廢渣——鋁灰,它主要含Al2O3、Al,還有SiO2等雜質。聚合氯化鋁生產的工藝流程如下:

(1)攪拌加熱操作過程中發生反應的離子方程式 ;
(2)生產過程中操作B和D的名稱均為 (B和D為簡單操作)。
(3)反應中副產品a是 (用化學式表示)。
(4)生產過程中可循環使用的物質是 (用化學式表示)。
(5)調節pH至4.0~4.5的目的是 。
(6)實驗室要測定水處理劑產品中n和x的值。為使測定結果更準確,需得到的晶體較純凈。生產過程中C物質可選用 。
A.NaOH | B.Al | C.氨水 | D.Al2O3E.NaAlO2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com