
【題目】水的電離平衡曲線如右圖所示,下列說法中,正確的是
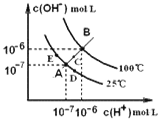
A. 圖中A、B、D三點處KW間的關系: B>A>D
B. 100℃,向pH=2的稀硫酸中逐滴加入等體積pH=10的稀氨水,溶液中 c(NH4+)/c(NH3·H2O)減小,充分反應后,溶液到達B點
C. 溫度不變,在水中加入適量NH4Cl固體,可從A點變化到C點
D. 加熱濃縮A點所示溶液,可從A點變化到B點
科目:高中化學 來源: 題型:
【題目】如右圖所示,將鐵棒和石墨棒插入盛有飽和NaCl溶液的U型管中。下列分析正確的是( )

A. K1閉合,鐵棒上發生的反應為2H++2e-→H2↑
B. K1閉合,石墨棒周圍溶液pH逐漸升高
C. K2閉合,鐵棒不會被腐蝕,屬于犧牲陽極的陰極保護法
D. K2閉合,電路中通過0.002NA個電子時,兩極共產生0.001mol氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有25 ℃時0.1 mol·L-1的氨水,請回答以下問題:
(1)若向氨水中加入少量硫酸銨固體,此時溶液中![]() ________(填“增大”、“減小”或“不變”)。
________(填“增大”、“減小”或“不變”)。
(2)若向氨水中加入稀硫酸,使其恰好中和,寫出反應的離子方程式:__________;所得溶液的pH________7(填“>”、“<”或“=”),用離子方程式表示其原因:__________;所得溶液中各離子物質的量濃度由大到小的順序是____________________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此時c(NH![]() )=a moL.L-1,則c(SO42-)為________。
)=a moL.L-1,則c(SO42-)為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用兩根金屬鉑做電極,以KOH溶液做電解質溶液,從兩極分別通入CH4(g)和O2,則對該燃料電池的下列敘述中正確的是 ( )
A. 負極的電極反應式為:CH4—8e-+10OH-=CO32-+7H2O
B. 負極的電極反應式為:4OH--4e-=2H2O+O2↑
C. 標準狀況下,通入5.6 LO2并完全反應后,有2.00mol電子轉移
D. 放電一段時間后,通入O2的電極附近溶液的pH降低
查看答案和解析>>
科目:高中化學 來源: 題型:
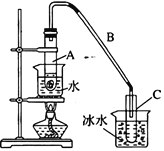
【題目】某化學小組采用類似制乙酸乙酯的裝置(如右圖所示),用環己醇制備環己烯。
已知: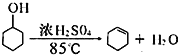
相對分子質量 | 密度/g cm-3 | 熔點/℃ | 沸點/℃ | 溶解性 | |
環己醇 | 100 | 0.96 | 25 | 161 | 能溶于水 |
環己烯 | 82 | 0.81 | -103 | 83 | 難溶于水 |
(1)制備粗品
將12.5 mL環己醇與1mL濃硫酸加入試管A中,搖勻后放入碎瓷片,緩慢加熱至反應完全,在試管C內得到環己烯粗品。
①在試管中混合環已醇和濃硫酸操作時,加入藥品的先后順序為_________。
②如果加熱一段時間后發現忘記加碎瓷片,應該采取的正確操作是_________(填字母)。
A.立即補加 B.冷卻后補加 C.不需補加 D.重新配料
③將試管C置于冰水中的目的是_______________________________。
(2)制備精品
①環己烯粗品中含有環己醇和少量酸性雜質等。向粗品中加入飽和食鹽水,振蕩、靜置、分層,環己烯在__________________層(填“上”或“下”),分液后用__________________(填字母)洗滌。
a.酸性KMnO4溶液 b.稀硫酸 c.Na2CO3溶液
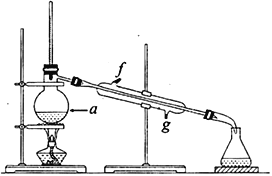
②再將提純后的環己烯按如圖所示裝置進行蒸餾。圖中儀器a 的名稱是_______________。實驗中冷卻水從__________(填字母)口進入。蒸餾時要加入生石灰,目的是__________________________。
(3)若在制備粗品時環已醇隨產品一起蒸出,則實驗制得的環己烯精品質量__________(填“高于”、“ 低于”)理論產量。本實驗所得到的環已烯質量為6.25g,則產率是___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】環保部門每天通過新聞媒體向社會發布以污染物濃度為標準確定空氣質量的信息.這些污染物是( )
A.二氧化硫、氮氧化物、懸浮微粒
B.二氧化硫、氮氧化物、一氧化碳
C.三氧化硫、氮氧化物、懸浮微粒
D.稀有氣體、氮氧化物、懸浮微粒
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com