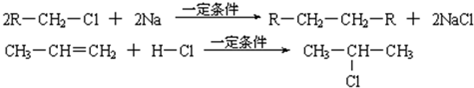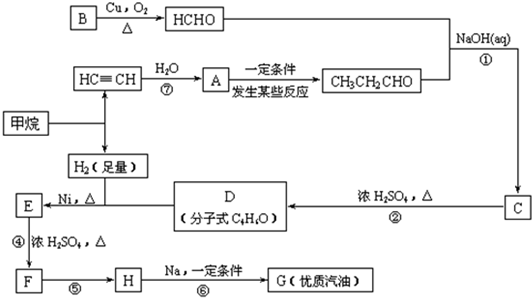
研究鐵及鐵的化合物的性質具有重要意義.
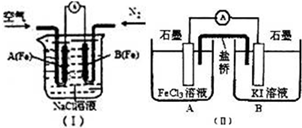
(1)如圖(I)是為研究鋼鐵腐蝕部位與水中O
2濃度的關系而設計的裝置,該裝置化學上稱為差異充氣電池.實驗中觀察到電流計指針偏轉,B(Fe)極被腐蝕,則A(Fe)極的電極反應式為
.
(2)常溫下,鐵可在某些強氧化劑溶液中形成鈍化膜而被保護.為探究鈍化膜的成分,取一小段鈍化后的鐵片放入稀硫酸中加熱,使鐵片完全溶解.取1mL溶解液滴入3~5滴KmnO
4溶液,觀察到溶液紫色逐漸退去,則該反應的離子方程式是
;另取1mL溶解滴入3~5滴KSCN溶液,發現溶液不變色.能否由此推斷鈍化膜中不含+3價的鐵?
(填“能”或“不能”),理由是
(用離子方程式表示).
(3)FeC1
3溶液與KI溶液混合,離子方程式為
.若要證明該反應為逆反應,某同學設計如下方法:
[方法1]取2mL0.1mol?L
-1
溶液(填化學式)于試管中,然后加入0.5mL0.1mol?L
-1
溶液(填化學式),充分振蕩后,將混合液分成兩份.一份加入
溶液(填化學式),若溶液變紅色;另一份加入
溶液(填化學式),若溶液變藍色,證明該反應為可逆反應.
[方法2]設計原電池裝置如圖(II),測得電流計指針偏轉方向是電子的流動方向.開始觀察到電流計指針向
(填“A”或“B”)集團,一段時間后,電流計指針不再偏轉.此時若要證明電池反應達到平衡狀態,可采取的方法及觀察到的現象為
.


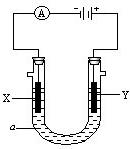 電解原理在化學工業中有廣泛應用.如圖表示一個電解池,裝有電解 液a;X、Y是兩塊電極板,通過導線與直流電源相連.請回答以下問題:
電解原理在化學工業中有廣泛應用.如圖表示一個電解池,裝有電解 液a;X、Y是兩塊電極板,通過導線與直流電源相連.請回答以下問題: 研究鐵及鐵的化合物的性質具有重要意義.
研究鐵及鐵的化合物的性質具有重要意義. Ⅰ山西河東地區是中華文明的發祥地之一,那里有一個被稱為“中國死海”的湖泊--運城鹽池.
Ⅰ山西河東地區是中華文明的發祥地之一,那里有一個被稱為“中國死海”的湖泊--運城鹽池.