
【題目】中國傳統文化中包括許多科技知識。下列古語中不涉及化學變化的是
千淘萬漉雖辛苦,吹盡狂沙始到金 |
熬膽礬(CuSO4·5H2O) 鐵釜,久之亦化為銅 |
凡石灰(CaCO3), 經火焚煉為用 |
丹砂(HgS)燒之成水銀,積變又成丹砂 |
A | B | C | D |
A. A B. B C. C D. D
科目:高中化學 來源: 題型:
【題目】下列圖示與對應的敘述正確的是

A. 圖甲表示有無催化劑的反應,加催化劑可以改變反應的焓變
B. 圖乙表示等濃度等體積的NaCl、NaBr及NaI溶液分別用AgNO3溶液滴定曲線,a為Cl-
C. 圖丙表示等濃度等體積的鹽酸和醋酸分別用NaOH溶液的滴定曲線,指示劑都可用酚酞
D. 圖丁表示反應2CO(g)+2NO(g)![]() N2(g)+2CO2(g),在其他條件不變時,改變起始CO的物質的量,平衡時N2的體積分數變化,由圖可知NO的轉化率b>c>a
N2(g)+2CO2(g),在其他條件不變時,改變起始CO的物質的量,平衡時N2的體積分數變化,由圖可知NO的轉化率b>c>a
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(I)2SO2(g)+O2(g) =2SO3(g)反應過程的能量變化如圖所示。
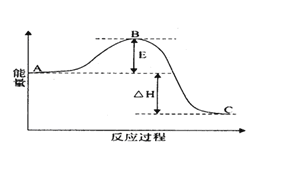
已知1molSO2(g)氧化為1molSO3(g)的△H=-99kJmol-1.請回答下列問題:
(1)E的大小對該反應的反應熱______(填“有”或“無”)影響。該反應通常用V2O5作催化劑,加V2O5會使圖中B點______(填“升高”還是“降低”)。
(2)完成SO2氧化為SO3的熱化學方程式______________________。
(II)用 50mL0.50mol/L 鹽酸與 50mL0.55mol/LNaOH 溶液在如圖所示的裝置中進行中和反應。通過測定反應過程中所放出的熱量可計算中和熱。回答下列問題:
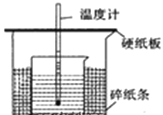
(1)從實驗裝置上看,圖中尚缺少的一種玻璃用品是_____________。實驗中能否用環形銅絲攪拌棒代替該用品_______(填“能”或“否”)
(2)向鹽酸溶液中加入NaOH溶液的正確操作是_______(從下列選出)。
A.沿玻璃棒緩慢倒入 B. —次迅速倒入 C.分三次少量倒入
(3)用相同濃度和體積的氨水(NH3·H2O)代替NaOH溶液進行上述實驗,測得的中和熱的數值會_____(填“偏大”、“偏小”、“無影響”)。
(4)小明利用上述裝置做實驗,測得中和熱的數值偏低,請你分析可能的原因是__________________。
A.測量完鹽酸的溫度再次測最NaOH溶液溫度時,溫度計上殘留的酸液未用水沖洗干凈。
B.做本實驗的當天室溫較高 C.大小燒杯口不平齊,小燒杯口未接觸硬紙板。
D.在量取鹽酸時仰視讀數 E.大燒杯的蓋板中間小孔太大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在容積為1.00L的容器中,通入一定量的N2O4,發生反應N2O4(g)![]() 2NO2(g),隨溫度升高,混合氣體的顏色變深。回答下列問題:
2NO2(g),隨溫度升高,混合氣體的顏色變深。回答下列問題:
(1)反應的△H______0(填“大于”“小于”);100℃時,體系中各物質濃度隨時間變化如圖所示。在0~60s時段,反應速率v(N2O4)為________molL-1s-1,反應的平衡常數K1為_________
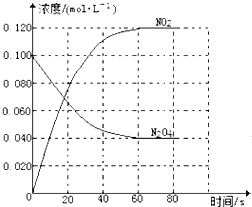
(2)100℃時達到平衡后,改變反應溫度為T,c(N2O4)以0.0020molL-1s-1的平均速率降低,經10s又達到平衡。
①T_______100℃(填“大于”“小于”),判斷理由是_____________________。
②列式計算溫度T時反應的平衡常數K2 =________。
(3)溫度T時反應達平衡后,將反應容器的容積減少一半,平衡向_______(填“正反應”或“逆反應”)方向移動,判斷理由是__________________。
(4)已知:
甲醇脫水反應2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烴反應2CH3OH(g)=C2H4 (g)+H2O(g) △H2=-29.1kJ·mol-1
乙醇異構化反應2CH3OH(g)=CH3OCH3(g)) △H3=+50.7kJ·mol-1
則乙烯氣相直接水合反應C2H4 (g)+H2O(g)=C2H5OH(g)的△H=____________ kJ·mol-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】生產生活中的許多現象或應用都與化學知識有關。下列現象或應用與膠體性質無關的是
A. 將鹽鹵或石膏加入豆漿,制成豆腐。
B. 一支鋼筆使用兩種不同型號的藍黑墨水,易出現堵塞。
C. 泡沫滅火器中將Al2(SO4)3與NaHCO3兩溶液混合后,噴出大量泡沫,起到滅火作用。
D. 清晨,人們經常能看到陽光穿過茂密的樹木枝葉所產生的美麗景象。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】天然氣和可燃冰(mCH4·nH2O)既是高效潔凈的能源,也是重要的化工原料。
(1)甲烷分子的空間構型為 ,可燃冰(mCH4·nH2O)屬于 晶體。
(2)已知25 ℃、101 kPa 時,1 g甲烷完全燃燒生成液態水放出55.64 kJ熱量,則該條件下反應
CH4(g)+2O2 (g)=CO2 (g)+2H2O (l)的ΔH= kJ/mol
(3)甲烷高溫分解生成氫氣和碳。在密閉容器中進行此反應時要通入適量空氣使部分甲烷燃燒,其目的是 。
(4)用甲烷空氣堿性(KOH溶液)燃料電池作電源,電解CuCl2溶液。裝置如圖所示:

①a電極名稱為 。
②c電極的電極反應式為 。
③假設CuCl2溶液足量,當某電極上析出3.2 g 金屬Cu時,理論上燃料電池消耗的空氣在標準狀況下的體積是 L(空氣中O2體積分數約為20%)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在恒溫恒容的容器中進行反應 2SO3(g)![]() 2SO2(g)+O2(g),若反應物濃度由1 mol/L降到0.8 mol/L需10s,那么由0.8 mol/L降到0.4 mol/L,需反應的時間為
2SO2(g)+O2(g),若反應物濃度由1 mol/L降到0.8 mol/L需10s,那么由0.8 mol/L降到0.4 mol/L,需反應的時間為
A. 等于10sB. 小于10sC. 等于20sD. 大于20s
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】認真觀察下列裝置,回答下列問題:
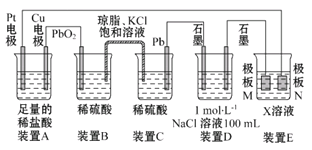
(1)裝置B中PbO2上發生的電極反應為____________________________。
(2)裝置A中總反應的離子方程式為______________________________。
(3)若裝置E的目的是在銅上鍍銀,則X為____,極板N的材料為____。
(4)當裝置A中Cu電極質量改變6.4 g時,裝置D中產生的氣體體積為____(標準狀況)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com